
 .
.分析 (1)氨气催化氧化生成一氧化氮和水;NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子;用氨把一氧化氮还原成无色无毒气体氮气,反应的方程式为:4NH3+6NO $\frac{\underline{\;催化剂\;}}{400℃}$5N2+6H2O;
(2)加热条件下浓硫酸能将木炭粉氧化,生成二氧化碳和二氧化硫,反应方程式为:2H2SO4(浓)+C $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2,应先通入品红溶液,若品红褪色则证明含有二氧化硫,然后通入酸性的高锰酸钾溶液除去二氧化硫,再通入品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水,若石灰水变浑浊,可以证明二氧化碳存在;
(3)还要检验溴单质与碘单质的氧化性强弱;氧化性Cl2>Br2>I2,从原子结构角度可以得出同主族元素从上到下,原子半径逐渐增大,得电子能力逐渐减弱.
解答 解:(1)工业上利用氨在催化剂存在的情况下与氧气反应来制备生产硝酸所需要的一氧化氮,氨气催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,
,
用氨把一氧化氮还原成无色无毒气体氮气,反应的方程式为:4NH3+6NO $\frac{\underline{\;催化剂\;}}{400℃}$5N2+6H2O,
故答案为:4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O, ;4NH3+6NO $\frac{\underline{\;催化剂\;}}{400℃}$5N2+6H2O;
;4NH3+6NO $\frac{\underline{\;催化剂\;}}{400℃}$5N2+6H2O;
(2)加热条件下浓硫酸能将木炭粉氧化,生成二氧化碳和二氧化硫,反应方程式为:2H2SO4(浓)+C $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2,应先通入品红溶液,若品红褪色则证明含有二氧化硫,然后通入酸性的高锰酸钾溶液除去二氧化硫,再通入品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水,若石灰水变浑浊,可证明二氧化碳存在,
故答案为:2H2SO4(浓)+C $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;④中品红溶液不褪色,⑤中溶液变浑浊;
(3)还要检验溴单质与碘单质的氧化性强弱,所以离子反应方程式为:Br2+2I-=2Br-+I2;氧化性Cl2>Br2>I2,从原子结构角度可以得出同主族元素从上到下,原子半径逐渐增大,得电子能力逐渐减弱,故答案为:Br2+2I-=2Br-+I2;同主族元素从上到下,原子半径逐渐增大,得电子能力逐渐减弱.
点评 本题考查卤素单质之间的置换反应的实验设计,把握单质的氧化性强弱及现象的分析为解答的关键,涉及氧化还原反应方程式的书写,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:实验题
| 药物名称 | 胃舒平(复方氢氧化铝) |
| 有效成分 | 氢氧化铝和三硅酸镁 |
| 不良反应 |  |
| 实验步骤 | (1)将药片3-4片研碎,向样品中滴加过量盐酸,过滤,得到澄清溶液; (2)向滤液中滴加NaOH溶液,观察是否出现白色沉淀; (3)如有白色沉淀生成,继续滴加NaOH溶液,观察白色沉淀是否溶解. |
| 结 论 | 胃舒平中含有氢氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 的系统命名为3-甲基-戊烷.
的系统命名为3-甲基-戊烷. .
. 中,共平面的碳原子最多有13个,共直线的原子最多有5个,该分子中有4种不同化学环境的H原子.
中,共平面的碳原子最多有13个,共直线的原子最多有5个,该分子中有4种不同化学环境的H原子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
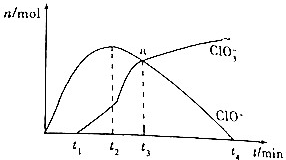 工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分为NaClO),某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO${\;}_{3}^{-}$的物质的量(mol)与反应时间t(min)的关系如图所示.下列说法错误的是( )
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分为NaClO),某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO${\;}_{3}^{-}$的物质的量(mol)与反应时间t(min)的关系如图所示.下列说法错误的是( )| A. | 参加反应所需要NaOH与氯气的物质的量之比一定为2:1 | |
| B. | a点时溶液中n(NaCl):n(NaClO3):n(NaClO)=6:1:1 | |
| C. | t2~t4min,ClO-的物质的量下降的原因可能是3ClO-═2Cl-+ClO${\;}_{3}^{-}$ | |
| D. | 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
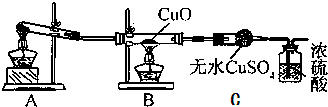
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com