
一定温度时,向容积为2 L的密闭容器中充入一定量的SO2和O2,发生反应,2SO2(g)+O2(g)2SO3(g)。反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是( )
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
A.反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.10 mol SO3和0.010 mol O2,到达平衡时,n(SO2)=0.012 mol
C.保持其他条件不变,升高温度,平衡时c(SO2)=0.007 0 mol·L-1,则反应的ΔH>0
D.相同温度下,起始时向容器中充入0.050 mol SO2和0.030 mol O2,达到平衡时SO2转化率大于88%
科目:高中化学 来源: 题型:
如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
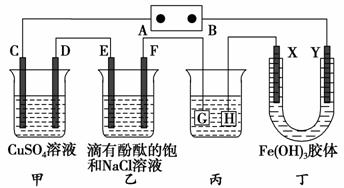
请回答:
(1)B极是电源的________,一段时间后,甲中溶液颜色________,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明____________________,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为______________。
(3)现用丙装置给铜件镀银,则H应该是________(填“镀层金属”或“镀件”),电镀液是________溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为________,甲中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是_______________________________________________________________
_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
| 体积分数/%温度/℃压强/MPa | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1 000 | e | f | 83.0 |
①b<f ②915 ℃,2.0 MPa时E的转化率为60% ③该反应的ΔS>0 ④K(1 000 ℃)>K(810 ℃)
上述①~④中正确的有( )
A.4个 B.3个 C.2个 D.1个
查看答案和解析>>
科目:高中化学 来源: 题型:
反应C(s)+H2O(g)CO(g)+H2(g)在一定密闭容器中进行,下列说法或结论中,能够成立的是( )
A.反应达平衡状态时:v(CO)正=v(H2O)逆
B.其他条件不变仅将容器的体积缩小一半,反应速率减小
C.保持体积不变,充入少量He使体系压强的增大,反应速率一定增大
D.其他条件不变,适当增加C(s)的质量会使反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个体积为2 L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
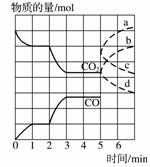
(1)反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g。用CO2的浓度变化表示的反应速率v(CO2)=__________。
(2)反应进行至2 min时,若升高温度,曲线发生的变化如图所示,3 min时再次达到平衡,则ΔH______0(填“>”、“<”或“=”)。
(3)5 min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是________(填写字母)。
a.v正先增大后减小 b.v正先减小后增大
c.v逆先增大后减小 d.v逆先减小后增大
表示n(CO2)变化的曲线是__________(填写图中曲线的字母编号)。
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为
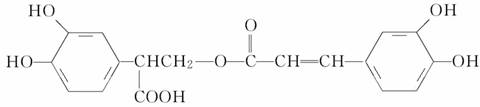 ,以邻苯二酚为原料合成迷迭香酸的路线为
,以邻苯二酚为原料合成迷迭香酸的路线为
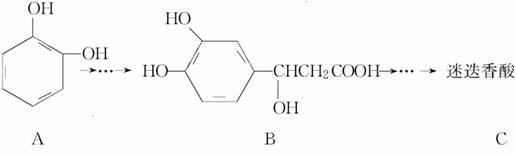
下列说法正确的是
A. 有机物B可以发生取代、加成、消去、氧化反应
B. 有机物A分子中所有原子一定在同一平面上
C. 有机物C在浓硫酸催化下水解的一种产物是B
D. 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
红珊瑚栖息于200~2000 m的海域,产于台湾海峡、南中国海,它与琥珀、珍珠被统称为有机宝石。在中国,珊瑚是吉祥的象征,一直用来制作珍贵的工艺品。红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,其红色是因为在海底长期积淀某种元素,该元素是( )
A.Na B.Fe
C.Si D.Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明醋酸是弱电解质,甲、乙、丙、丁四人分别选用下列试剂进行实验:0.1 mol·L-1醋酸溶液、0.1 mol·L-1盐酸、pH=3的盐酸、pH=3的醋酸、CH3COONa晶体、NaCl晶体、CH3COONH4晶体、蒸馏水、锌粒、pH试纸、酚酞、NaOH溶液等。
(1)甲取出10 mL 0.1 mol·L-1的醋酸溶液,用pH试纸测出其pH=a,确定醋酸是弱电解质,则a应该满足的关系是
________________________________________________________________________,
理由是________________________________________________________________________。
(2)乙分别取pH=3的醋酸和盐酸各1 mL,分别用蒸馏水稀释到100 mL,然后用pH试纸分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是________________________________________________________________________。
(3)丙分别取pH=3的盐酸和醋酸各10 mL,然后加入质量相同的锌粒,醋酸放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗?________,请说明理由:________________________________________________________________________
________________________________________________________________________。
(4)丁用CH3COONa晶体、NaCl晶体、蒸馏水和酚酞做实验,也论证了醋酸是弱酸的事实,该同学的实验操作和现象是____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com