
| t/min | 2 | 4 | 6 | 8 | 10 |
| n(A)/mol | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率ν(C)=0.02 mol•L-1•min-1 | |
| B. | 平衡后降低温度,反应达到新平衡前ν(逆)>ν(正) | |
| C. | 其他条件不变,10 min后再充入一定量的A,平衡正向移动,A的转化率变小 | |
| D. | 保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同 |
分析 A.由方程式可知,反应前2 min内△c(C)=△c(A)=0.2mol-0.16mol=0.04mol,再根据v=$\frac{△c}{△t}$计算v(C);
B.正反应为放热反应,降低温度平衡正向移动;
C.增大某一反应物浓度,平衡正向移动,其它反应物转化率增大,自身转化率减小;
D.正反应为气体物质的量减小的反应,恒温恒容下平衡时压强减小,等效在恒温恒压下平衡基础上减小压强.
解答 解:A.由方程式可知,反应前2 min内△c(C)=△c(A)=0.2mol-0.16mol=0.04mol,容器容积为10L,则v(C)=$\frac{\frac{0.04mol}{10L}}{2min}$=0.002mol/(L.min),故A错误;
B.正反应为放热反应,降低温度平衡正向移动,反应达到新平衡前ν(逆)<ν(正),故B错误;
C.其他条件不变,10 min后再充入一定量的A,A的浓度增大,平衡正向移动,但A的转化率变小,故C正确;
D.正反应为气体物质的量减小的反应,恒温恒容下平衡时压强减小,等效在恒温恒压下平衡基础上减小压强,平衡逆向移动,故恒温恒容下A的体积分数更大,故D错误,
故选:C.
点评 本题考查化学平衡影响、化学反应速率计算,D选项中注意构建等效平衡建立的途径进行分析解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
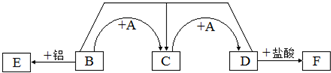
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝受热分解 | |
| B. | 氧化铜与硝酸反应 | |
| C. | 实验室中用高锰酸钾加热分解制取 氧气 | |
| D. | 实验室中用氯化铵固体与氢氧化钙固体制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚遇三氯化铁溶液变血红色 | B. | 淀粉溶液遇碘酸钾变蓝色 | ||
| C. | 植物油遇溴水变黄色 | D. | 氧化铜遇热的乙醇变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾处理水时,高铁酸钾发生还原反应 | |
| B. | 湿法中每生成1mol Na2FeO4共转移3mol电子 | |
| C. | 干法中每生成1mol Na2FeO4共转移4mol电子 | |
| D. | K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积/mL | 标准碘溶液体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均值 | ||
| 1 | 25.00 | 0.00 | 14.97 | ① |
| 2 | 25.00 | 0.10 | 15.13 | |
| 3 | 25.00 | 0.22 | 14.93 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

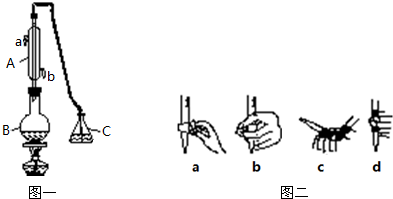
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14.2克 Na2SO4含有的Na+离子数为0.2NA | |
| B. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| C. | 通常状况下,NA个N2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com