
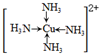
 ,离子方程式是Cu+4NH3?H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-,故答案为:析出深蓝色晶体;
,离子方程式是Cu+4NH3?H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-,故答案为:析出深蓝色晶体; ;Cu+4NH3?H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-;
;Cu+4NH3?H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-;

科目:高中化学 来源: 题型:
| A、铝在常温下不能与氧气反应 |
| B、氧化铝只能与酸反应,不能与碱反应 |
| C、碳酸钠溶液和碳酸氢钠溶液中滴入酚酞溶液,溶液均显红色 |
| D、过氧化钠可用于呼吸面具中作为二氧化碳气体的来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在食品保鲜袋中放置硫酸亚铁和硅胶可以防止食品氧化变质及受潮 |
| B、金属元素的原子只有还原性,其阳离子只有氧化性 |
| C、玻璃、水泥、陶瓷都是硅酸盐材料 |
| D、Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
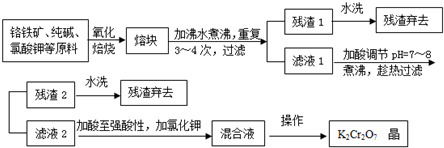
| ||
| ||
| 温 度 | 10℃ | 20℃ | 50℃ | 80℃ | 100℃ |
| K2Cr2O7溶解度(g) | 8.5 | 13.1 | 37.0 | 73.0 | 102.0 |
| NaCl溶解度(g) | 35.8 | 36.0 | 37.0 | 38.4 | 39.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后
| ||||||
| B、参加反应的氯气的物质的量等于0.5amol | ||||||
C、改变温度,反应中转移电子的物质的量ne的范围:
| ||||||
D、改变温度,产物中KC1O3的最大理论产量为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li Na K |
| B、Na Mg Al |
| C、Li Be Mg |
| D、Li Na Mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com