
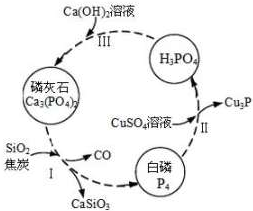
 磷及部分重要化合物的相互转化如图所示.
磷及部分重要化合物的相互转化如图所示.| 1 |
| 20 |
| 1 |
| 20 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
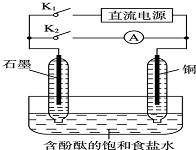 某兴趣小组设计如下微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生:一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )
某兴趣小组设计如下微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生:一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )| A、断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-═Cl2↑+H2↑ |
| B、断开K1,闭合K2时,石墨电极作正极 |
| C、断开K2,闭合K1时,石墨电极附近溶液变红 |
| D、断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-═2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、④⑥⑦ |
| C、①④⑦ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
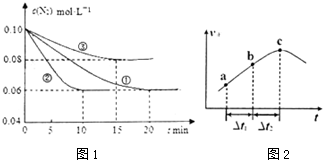
| ||
| 催化剂 |
| 容器 | 甲 | 乙 | 丙 |
| 起始物质投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 、2molNH3 |
| 达到平衡的时间 /min | t | 5 | 8 |
| 平衡时N的浓度/mol.L-1 | c1 | 3 | |
| N的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度/g.L-1 | ρ1 | ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+=Mg(OH)↓+H2O |
| B、向NaAlO2溶液中通入过量CO2的反应为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| C、等物质的量的FeBr2与Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
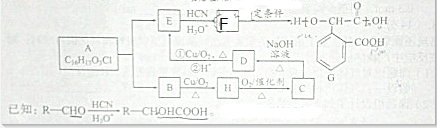
查看答案和解析>>
科目:高中化学 来源: 题型:
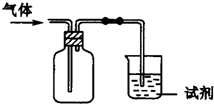 )
)| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
| B | C2H4 | 溴水 | 溶液褪色 | 能发生加成反应 |
| C | X | 澄清石灰水 | 溶液变浑浊 | X不一定是CO2 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com