
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
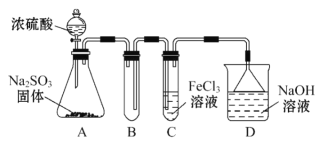
(1)通入足量SO2时C中观察到的现象为____。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式___;
②C装置中所盛装的FeCl3溶液为5mL,物质的量浓度为2.0mol·L-1,欲使其完全被SO2还原,则至少需要Na2SO3固体___g;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO![]() 。该做法___(填“合理”或“不合理”),理由是___。
。该做法___(填“合理”或“不合理”),理由是___。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有___(填序号)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质](15分)
人体必需的元素包括常量元素与微量元素,常量元素包括碳、氢、氧、氮、钙、镁等,微量元素包括铁、铜、锌、氟、碘等,这些元素形成的化合物种类繁多,应用广泛。
(1)锌、铜、铁、钙四种元素与少儿生长发育息息相关,请写出Fe2+的核外电子排布式__________。
(2)1个Cu2+与2个H2N—CH2—COO形成含两个五元环结构的内配盐(化合物),其结构简式为_______________(用→标出配位键),在H2N—CH2—COO中,属于第二周期的元素的第一电离能由大到小的顺序是__________(用元素符号表示),N、C原子存在的相同杂化方式是_________杂化。
(3)碳酸盐中的阳离子不同,热分解温度就不同,查阅文献资料可知,离子半径r(Mg2+)=66 pm,r(Ca2+)=99 pm,r(Sr2+)=112 pm,r(Ba2+)=135 pm;碳酸盐分解温度T(MgCO3)=402℃,T(CaCO3)=825℃,T(SrCO3)=1172℃,T(BaCO3)=1360℃。分析数据得出的规律是_____________,解释出现此规律的原因是____________________________________。
(4)自然界的氟化钙矿物为萤石或氟石,CaF2的晶体结构呈立方体形,其结构如下:
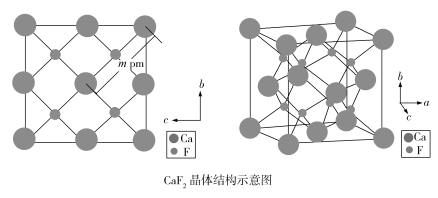
①两个最近的F之间的距离是___________pm(用含m的代数式表示)。
②CaF2晶胞体积与8个F形成的立方体的体积比为___________。
③CaF2晶胞的密度是___________g·cm3(化简至带根号的最简式,NA表示阿伏加德罗常数的值)。
[化学——选修5:有机化学基础](15分)
药物H在人体内具有抑制白色念球菌的作用,H可经下图所示合成路线进行制备。
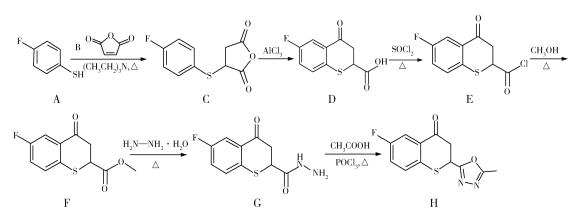
已知:硫醚键易被浓硫酸氧化。
回答下列问题:
(1)官能团SH的名称为巯(qiú)基,SH直接连在苯环上形成的物质属于硫酚,则A的名称为________________。D分子中含氧官能团的名称为________________。
(2)写出下列反应类型:A→C_____________,E→F_____________。
(3)F生成G的化学方程式为_______________________________________。
(4)下列关于D的说法正确的是_____________(填标号)。(已知:同时连接四个各不相同的原子或原子团的碳原子称为手性碳原子)
A.分子式为C10H7O3FS
B.分子中有2个手性碳原子
C.能与NaHCO3溶液、AgNO3溶液发生反应
D.能发生取代、氧化、加成、还原等反应
(5)M与A互为同系物,分子组成比A多1个CH2,M分子的可能结构有_______种;其中核磁共振氢谱有4组峰,且峰面积比为2∶2∶2∶1的物质的结构简式为_____________。
(6)有机化合物K(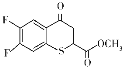 )是合成广谱抗念球菌药物的重要中间体,参考上述流程,设计以
)是合成广谱抗念球菌药物的重要中间体,参考上述流程,设计以 为原料的合成K的路线。_____________
为原料的合成K的路线。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:l的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中对应关系正确的是
A | CH3CH3+Cl2 | 均为取代反应 |
B | 由油脂得到甘油 | 均发生了水解反应 |
C | Cl2+2Br=2Cl+Br2 | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O+4NaOH+O2↑ | 均为水作还原剂的氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废旧塑料的再利用。下列叙述不正确的是
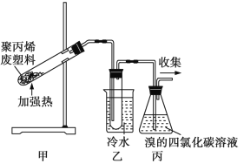
A.装置乙试管中收集到的液体在催化剂存在下可以与Br2发生取代反应
B.装置丙中的试剂吸收反应产生的气体后得到的产物的密度均比水大
C.最后收集的气体可以作为清洁燃料使用
D.甲烷的二氯代物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为探究温度、压强对可逆反应A(g)+B(g) ![]() C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的量浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3]。请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的量浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3]。请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是
A | B | C | |
浓度1 | 0.05 mol·L-1 | a mol·L-1 | 0.05 mol·L-1 |
浓度2 | 0.078 mol·L-1 | 0.078 mol·L-1 | 0.022 mol·L-1 |
浓度3 | 0.06 mol·L-1 | 0.06 mol·L-1 | 0.04 mol·L-1 |
浓度4 | 0.07 mol·L-1 | 0.07 mol·L-1 | 0.098 mol·L-1 |
A. 由[浓度3]与[浓度1]的比较,可判断平衡移动的原因是增大了体系的压强
B. 由[浓度2]与[浓度1]的比较,可判断正反应是放热反应
C. [浓度1]中a=0.05
D. 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4]。与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
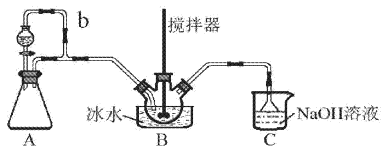
(1)装置A制取SO2
①A中反应的化学方程式为___。
②导管b的作用是___。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是___(只写1种)。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是___。
(3)装置C的主要作用是___(用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是___。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__MnO4-+__C2O42-+__=__Mn2++__+__H2O
②滴定终点时的现象为___。
③亚硝酰硫酸的纯度=___。(精确到0.1%)[M(NOSO4H)=127g·mol-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
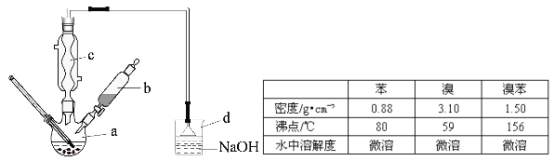
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 ③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。
A.25mL B. 50mL C.250mL D.500mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com