
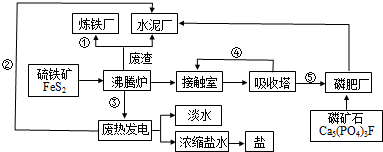
分析 硫铁矿含有FeS2,在沸腾炉中充分反应可生成Fe2O3、SO2,反应放出的热量可用于发电,生成的Fe2O3可用于冶炼铁,二氧化硫可用于生产水泥,二氧化硫可在接触室生成三氧化硫,在吸收塔生成硫酸,加入Ca5(PO4)3F,可生成Ca(H2PO4)2、CaSO4,可用作磷肥,
(1)根据流程图中工业生产的原料,及发生的反应中的能量转化;
(2)接触室中二氧化硫与氧气反应生成三氧化硫;磷矿石和硫酸反应生成Ca(H2PO4)2、CaSO4以及HF;
(3)根据FeS2制取硫酸过程中涉及的化学反应方程式,利用关系法解题;
(4)吸收三氧化硫,避免形成酸雾;
(5)根据工厂的废气、废渣的成分分析.
解答 解:(1)①中冶炼钢铁的原料是Fe2O3,②中热电厂中向外提供的能量为电能,③沸腾炉中FeS2与氧气反应放出大量的热,④制硫酸时接触室中二氧化硫被氧化,⑤硫酸工业中生成的硫酸,可用于制磷肥,
故答案为:①Fe2O3 ②电能 ③热能 ④SO2 ⑤H2SO4;
(2)接触室中二氧化硫与氧气反应生成三氧化硫,方程式为2SO2+O2 $\frac{\underline{\;催化剂\;}}{△}$ 2SO3,普钙是磷酸二氢钙和硫酸钙,用硫酸与磷酸钙反应生成硫酸钙和磷酸二氢钙的化学方程式为2Ca5(PO4)3F+7H2SO4=3Ca(H2PO4)2+7CaSO4+2HF,
故答案为:2SO2+O2 $\frac{\underline{\;催化剂\;}}{△}$ 2SO3;2Ca5(PO4)3F+7H2SO4=3Ca(H2PO4)2+7CaSO4+2HF;
(3)FeS2制取硫酸过程中,设生成的98%的硫酸为x吨,利用关系法列式,硫元素守恒,
FeS2 ~2H2SO4
120 2×98
1×36%×65% 98%x
x=0.39,
故答案为:0.39;
(4)吸收三氧化硫,避免形成酸雾,可用浓硫酸吸收,具体为98.3%的浓H2SO4,原因是用水吸收易形成酸雾,不利于SO3的吸收,
故答案为:98.3%的浓H2SO4;用水吸收易形成酸雾,不利于SO3的吸收;
(5)根据工厂的废气、废渣的成分可知,废气(主要是高炉煤气)经除尘后可作为热风炉、加热炉和锅炉等燃料;废渣(主要成分是硅酸钙等),可用作水泥生产原料,用于生产磷肥等.
故答案为:废气(主要是高炉煤气)经除尘后可作为燃料、冶炼金属的原料;废渣(主要成分是硅酸钙等),可用作水泥生产原料;废渣(主要成分是硅酸钙等),可用作矿渣磷肥的生产原料.
点评 本题考查了工艺流程,为高考常见题型,侧重于学生的分析、计算能力的考查,题目涉及硫酸工业、水泥工业、磷肥工业、海水的应用等知识,内容较多,题目难度中等,注意根据对应的工业反应原理分析.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向KBrO2溶液中加入少量苯,然后通入少量Cl2 | 有机层呈橙色 | 氧化性:Cl2>KBrO2 |
| B | 向KNO3和KOH混合溶液中加入铝粉并加热,将湿润的红色石蕊试纸放在试管口 | 试纸变为蓝色 | NO${\;}_{3}^{-}$被还原为NH3 |
| C | 向0.1mol•L-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 将0.1mol•L-1的MgSO4溶液滴入到NaOH溶液中至不再有沉淀产生,再滴加0.1mol•L-1的CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁吸氧腐蚀过程中正极反应为2H++2e-═H2↑ | |
| B. | 惰性电极电解熔融NaCl时阴极、阳极产生气体体积比为1:1 | |
| C. | H2在反应Li2NH+H2═LiNH2+LiH中既是氧化剂又是还原剂 | |
| D. | 用铁做电极电解CuCl2溶液的离子方程式为Cu2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离出的c(H+)=10-13mol•L溶液:Na+、NH4+、CO32-、SO42- | |
| B. | 澄清透明溶液:Mg2+、Cu2+、SO42-、Cl- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014溶液:Ba2+、Na+、ClO-、NO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com