
【题目】下列实验能达到相应目的是( )
选项 | A | B | C | D |
实验 过程 |
|
|
|
|
实验 目的 | 将乙二醇(HOCH2CH2OH)转化为乙二酸(H2C2O4) | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用SO2与Ba(NO3)2反应获得BaSO3沉淀 |
A. A B. B C. C D. D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
铬、锰、铁、钴、镍等过渡金属元索的单质及其化合物在工农业、国防、科技等领域具存广泛应用。
(1)基态Cr原子中有_________个未成对电子,最外层电子所占用能级的电子云形状为_______。
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关,一般地,为d0或d10排布时,无颜色;为d1d9排布时,有颜色。则:[Mn(H2O)6]2+ ________(填“无”或“有”)颜色。
(3)不同温度下,铁单质晶胞的两种堆积方式如图所示

①图1和图2中Fe原子的配位数分别为_______________和________________。
②若图2的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中两个最近的Fe原子之间的距离为__________pm。(用含ρ、NA的代数式表示)
(4)已知MgO与NiO的晶体结构(如图3)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO__________NiO(填“>”“<”或“=”),理由是_______________。若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图4),已知O2-的半径为ɑ m,每平方米面积上分散的该晶体的质量为_________g。(用含ɑ、NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酯增塑剂H及某医药中间体F的一种合成路线如下(部分反应条件略去):

已知: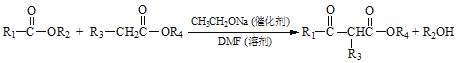
试回答下列问题:
(1)F中官能团名称为________;反应②的试剂和条件是_________________。
(2)Y的名称是_______;根据“绿色化学”原理,反应④的原子利用率为_______%。(保留小数点后一位)
(3)写出反应⑤的化学方程式_______________________。
(4)与C具有相同官能团且官能团数目相同的同分异构体还有_______种;⑥的反应类型是_______。
(5)B有多种同分异构体,其中在核磁共振氢谱上只有2个峰的结构简式为_________。
(6)利用以上合成路线的信息,设计一条以苯甲酸乙酯和乙醇为原料合成 的路线_______。(无机试剂任选)
的路线_______。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g) ![]() 2AB2(g)△H<0,下列说法正确的是( )
2AB2(g)△H<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。
(1)磷元素位于元素周期表第_______周期______族。AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为____________。
(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:________
□CuSO4+□PH3+□H2O═□Cu3P↓+□H3PO4+□H2SO4
(3)工业制备PH3的流程如图所示。

①黄磷和烧碱溶液反应的化学方程式为_________,次磷酸的化学式为____________,次磷酸属于___________(填“一”“二”或“三”)元酸。
②若起始时有1molP4参加反应,则整个工业流程中共生成 ______ mol PH3.(不考虑产物的损失)
II.某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨。

①a表示__________离子交换膜(填“阴”或“阳”)。A-E分别代表生产中的原料或产品。其中C为硫酸,则A表示_____________。E表示___________________。
②阳极的电极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜的配合物A(结构如图)。请回答下列问题:
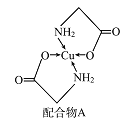
(1)Cu的简化电子排布式为______________ 。
(2)A所含三种元素C、N、O的第一电离能由大到小的顺序为_______________。其中氮原子的杂化轨道类型为________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比
是__________;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为_______。
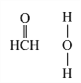
(4)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H CO的键角___________(选填“大于”、“等于”或“小于”)120°;甲醛能与水形成氢键,请在右图中表示出来___________。
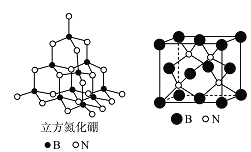
(5)立方氮化硼(如图)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___________;结构化学上用原子坐标参数表示晶胞内部各原子的相对位置,上图(右)立方氮化硼的晶胞中,B原子的坐标参数分别有:
![]() 等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理元素化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) △H=+133.6 kJ·mol-1。该反应的化学平衡常数的表达式K=_________。
2NH3(g)+CO2(g) △H=+133.6 kJ·mol-1。该反应的化学平衡常数的表达式K=_________。
关于该反应的下列说法正确的是________(填序号)。
A.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
B.在平衡体系中增加水的用量可使该反应的平衡常数增大
C.当容器中NH3的体积分数不再改变时,反应处于平衡状态
②尿素在一定条件下可将氮的氧化物还原为氮气。

根据图像,结合①中信息,尿素还原NO(g)的热化学方程式是_________。
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:
CO2(g)+2NH3(g)![]() CO(NH2)2+H2O(g),混合气体中NH3 的物质的量百分含量[φ(NH3)]随时间变化关系如图所示。则a点的正反应速率V正(CO2)_____b点的逆反应速率V逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是_______。
CO(NH2)2+H2O(g),混合气体中NH3 的物质的量百分含量[φ(NH3)]随时间变化关系如图所示。则a点的正反应速率V正(CO2)_____b点的逆反应速率V逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是_______。
(2)在T℃下,分别在三个容积为10L的恒容绝热密闭容器中,发生反应: 2CO(g)+SO2(g) ![]() S(g)+2CO2(g) △>0, 测得相关数据如下表所示。
S(g)+2CO2(g) △>0, 测得相关数据如下表所示。

下列说法不正确的是________
A.反应开始时的速率:丙>乙 B. b=1.6 C.平衡常数:甲>乙
(3)ClO2是一种安全稳定的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2原理如下:

①a电极上产生的NCl3分子,常温下是一种黄色粘稠的油状液体,该分子的电子式为______。
②电解池中总反应的离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com