
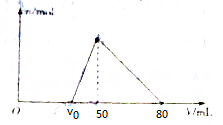
 将一定量的Al2O3加入到100mL NaOH溶液中,固体全部溶解,向所得溶液中逐滴加入1.0mol•L-1的盐酸,所得沉淀的物质的量与加入盐酸体积的关系如图所示(不考虑溶液体积的变化),则下列说法正确的是( )
将一定量的Al2O3加入到100mL NaOH溶液中,固体全部溶解,向所得溶液中逐滴加入1.0mol•L-1的盐酸,所得沉淀的物质的量与加入盐酸体积的关系如图所示(不考虑溶液体积的变化),则下列说法正确的是( )| A. | NaOH溶液的浓度为1.0mol•L-1 | |
| B. | Al2O3的质量为0.51g | |
| C. | v0的数值为35 | |
| D. | 沉淀量达到最大时,溶液中的溶质有两种 |
分析 A、沉淀量最大时是氯化钠的水溶液,根据组成可得钠离子与氯离子的物质的量相等,可求得NaOH溶液的物质的量浓度;
B、50ml→80ml发生反应Al(OH)3+3H+=Al3++3H2O,根据Al2O3~2Al(OH)3,求Al2O3的质量;
C、偏铝酸钠与盐酸生成氢氧化铝消耗的盐酸是氢氧化铝与盐酸反应消耗的盐酸的$\frac{1}{3}$;
D、沉淀量达到最大时,是氯化钠的水溶液.
解答 解:A、沉淀量最大时是氯化钠的水溶液,n(HCl)=1.0mol•L-1×0.05L=0.05mol,所以n(NaOH)=n(HCl)=0.05mol,则NaOH溶液的物质的量浓度是$\frac{0.05mol}{0.1L}$=0.5mol/L,故A错误;
B、50ml→80ml发生反应Al(OH)3 +3H+=Al3++3H2O,
1mol 3mol
n(Al(OH)3) (80-50)×1×10-3
所以 n(Al(OH)3)=0.01mol,则n(Al2O3)=$\frac{1}{2}$×0.01=0.005mol,所以m(Al2O3)=0.005mol×102g/mol=0.51g,故B正确;
C、偏铝酸钠与盐酸生成氢氧化铝消耗的盐酸是氢氧化铝与盐酸反应消耗的盐酸的$\frac{1}{3}$,所以V0→50的体积为:(80-50)×$\frac{1}{3}$=10ml,所以V0=50-10=40ml,故C错误;
D、沉淀量达到最大时,是氯化钠的水溶液,而不是两种溶质,故D错误;
故选B.
点评 本题考查以图象题的形式考查铝的重要化合物的计算,题目难度中等,注意分析图象各阶段的物质的量的关系,根据各阶段的化学反应,利用守恒计算.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{92}^{235}$U和${\;}_{53}^{131}$I是同位素 | |
| B. | ${\;}_{53}^{131}$I的质子数为131 | |
| C. | ${\;}_{92}^{235}$U的中子数是143 | |
| D. | ${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs是同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 取不同体积的KCl溶液 | 取相同体积的两种溶液 | |
| c(溶质) | 相同 | 相同 |
| ρ(溶质) | 相同 | 不同 |
| n(溶质) | 不同 | 相同 |
| m(溶质) | 不同 | 不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L苯的分子数约为NA个 | |
| B. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| C. | 100mL1mol/LCH3COOH溶液跟足量钠反应,生成的氢气分子数为0.05NA | |
| D. | 常温下,在1molC5H12中含有共价键数15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:3:5 | B. | 5:1:3 | C. | 3:1:5 | D. | 2:4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | wx mol-1 | B. | 22.4x mol-1 | C. | $\frac{22.4x}{ω}$mol-1 | D. | $\frac{11.2x}{ω}$mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{125}I$是碘的一种核素 | |
| B. | ${\;}_{53}^{125}I$核内的中子数与核外电子数之差为19 | |
| C. | ${\;}_{53}^{125}I$质量数为l25 | |
| D. | ${\;}_{53}^{125}I$是一种新发现的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com