
【题目】亚硝酸钠大量用于染料和有机合成工业。用木屑制备亚硝酸钠的流程如下:

已知:①氧化过程中,控制反应液的温度在55~60℃,发生的主要反应为C6H12O6+12HNO3![]() 3H2C2O4+9NO2↑+3NO↑+9H2O;
3H2C2O4+9NO2↑+3NO↑+9H2O;
②NaNO2有氧化性,在酸性条件下能把I-氧化为I2;S2O32-能把I2还原为I-
③NaNO2也有还原性,能使酸性KMnO4溶液褪色
(1)酸溶过程中,发生的主要反应的化学方程式为______________。
(2)实验室模拟氧化和吸收过程的装置(加热和仪器固定裝置已略去)如下图所示

①实验装置图中仪器a的名称为______________。
②A装置须控制反应液的温度不高于60℃的原因是_____________。
③B装置用于制备亚硝酸钠,其中盛放的溶液是__________(填字母)。
a.NaCl溶液 b.Na2CO3溶液 c.NaNO3溶液
(3)工业上在吸收过程中需控制NO和NO2的物质的量比接近1:1。若n(NO):n(NO2)>l:1,则会导致________;若n(NO):n(NO2)<1:1,则会导致________。
(4)为测定产品NaNO2的纯度,请补充完整实验方案:准确称量适量的NaNO2样品放入锥形瓶中,加适量水溶解,________。(实验中可供选择的试剂:稀硫酸、淀粉溶液、酚酞试液、c1mol/LKI溶液、c2mol/LNa2S2O3溶液、c3mol/L酸性KMnO4溶液)
【答案】 ![]() 分液漏斗 温度过高会导致HNO3分解,降低NaNO2的产率 b 排放气体中NO含量升高 产品NaNO2 中NaNO3含量升高 用c3 mol/L酸性KMnO4溶液滴定,当溶液由无色恰好变为浅红色,且半分钟内不褪色时读数,重复以上操作2~3次,计算NaNO2的纯度
分液漏斗 温度过高会导致HNO3分解,降低NaNO2的产率 b 排放气体中NO含量升高 产品NaNO2 中NaNO3含量升高 用c3 mol/L酸性KMnO4溶液滴定,当溶液由无色恰好变为浅红色,且半分钟内不褪色时读数,重复以上操作2~3次,计算NaNO2的纯度
【解析】试题分析:本题考查工业流程的分析,物质的制备,物质纯度测定的实验方案的设计。
(1)木屑的主要成分为纤维素,酸溶时纤维素发生水解反应生成葡萄糖,反应的化学方程式为![]() 。
。
(2)①根据仪器的构造特点,仪器a的名称为分液漏斗。
②A装置中发生的反应为:C6H12O6+12HNO3![]() 3H2C2O4+9NO2↑+3NO↑+9H2O,控制反应温度不高于60℃的原因是:防止温度过高HNO3分解和挥发,降低NaNO2的产率。
3H2C2O4+9NO2↑+3NO↑+9H2O,控制反应温度不高于60℃的原因是:防止温度过高HNO3分解和挥发,降低NaNO2的产率。
③A装置中产生NO2和NO的混合气体,工业流程中用NaOH溶液吸收混合气制备NaNO2;三种盐溶液只有Na2CO3溶液呈碱性,装置B中盛放的溶液为Na2CO3溶液,Na2CO3溶液吸收该混合气体生成NaNO2的化学方程式为NO+NO2+Na2CO3=2NaNO2+CO2;NaCl溶液、NaNO3溶液只能吸收混合气体中的NO2生成HNO3;答案选b。
(3)工业上吸收混合气体生成NaNO2的反应为:NO+NO2+2NaOH=2NaNO2+H2O。若n(NO):n(NO2)>l:1,发生上述反应后NO过量,过量的NO不能被NaOH溶液吸收,则会导致排放气体中NO含量升高。若n(NO):n(NO2)<1:1,发生上述反应后NO2过量,过量的NO2与NaOH发生反应:2NO2+2NaOH=NaNO3+NaNO2+H2O,则会导致产品NaNO2中NaNO3的含量升高。
(4)由于NaNO2产品中含有NaNO3,根据题意,NaNO2有氧化性,在酸性条件下能把I-氧化为I2;NaNO2也有还原性,能使酸性KMnO4溶液褪色;酸性条件下NaNO3也有氧化性,也能将I-氧化为I2;NaNO3与酸性KMnO4溶液不反应;所以选用酸性KMnO4溶液进行滴定实验,由于KMnO4溶液本身有颜色,所以滴定时不必使用指示剂。实验方案为:准确称量适量的NaNO2样品放入锥形瓶中,加适量水溶解,用c3mol/L酸性KMnO4溶液滴定,当溶液由无色恰好变为浅红色,且半分钟内不褪色时读数,重复以上操作2~3次,计算NaNO2的纯度。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某溶液中阳离子只含K+,其中Cl-、Br-、I-的个数比为1∶2∶3,欲使这些离子个数比变为3∶2∶1,需要通入的氯分子与原溶液中I-的个数比应为( )
A.1∶2 B.2∶1 C.1∶3 D.3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
A.蛋白质在人体内水解为氨基酸和甘油等小分子物质后才能被吸收
B.丝绸的主要成分是天然纤维素,属于高分子化合物
C.高铁车用大部分材料是铝合金,铝合金材料具有质量轻、抗腐蚀能力强等优点
D.中秋节吃月饼,为防止月饼富脂易变质,常在包装袋中加入生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列叙述,推测可能属于金属晶体的是( )
A.由分子间作用力结合而成,熔点很低
B.固体或熔融状态下易导电,熔点在1000℃左右
C.由共价键结合成空间网状结构,熔点很高
D.固体不导电,熔融状态下亦不导电,但溶于水后能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:

(1)正四面体烷的分子式为________________,其二氯取代产物有_________种;
(2)关于乙烯基乙炔分子的说法错误的是:________。
a、能使酸性KMnO4溶液褪色
b、1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
c、生成乙烯基乙炔分子的反应属于取代反应
d、等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:________________;
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例): ________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
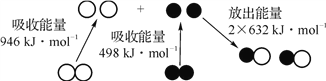
A. 放电条件下,N2(g)和O2(g)混合能直接化合生成NO(g)
B. NO是一种酸性氧化物,能用NaOH溶液处理含NO的尾气
C. N2(g)和O2(g)反应生成 NO(g),相当于N2(g)在O2(g)燃烧,该反应放热
D. 28 g N2(g)和32 g O2(g)完全反应生成 NO(g),放出的能量为180 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的用途不正确的是( )
A. 硅是制造光导纤维的材料
B. 硅是制造太阳能电池的常用材料
C. 二氧化硅是制取粗硅的原料
D. 水玻璃可用作木材防火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c2一定大于0.3 mol·L-1 B. c1∶c2 一定等于1∶3
C. 平衡时,Y和Z的生成速率之比为2∶3 D. c3的取值范围为0.08<c3<0.28 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com