
 如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A. | 平衡时A气体在两容器中体积分数可能相等 | |
| B. | 若x:y=1:2,则平衡时,M中的转化率:A>B | |
| C. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| D. | 若x=1,y=3,则达到平衡时反应物的转化率N>M |
分析 M容器保持恒容,N容器保持恒压,由于反应前后的气体系数和不等,所以两个平衡态也不一样,
A、让M、N中平衡时A的体积分数一样,那么只能是M或N中,反应前后不论限度多少,A的体积分数始终为定值,假定反应的A为zmol,利用三段式表示平衡时各组分的物质的量据此判断;
B、由于x:y=1:2,即y=2 x,设反应中消耗掉amolA,用a表示参加反应的B的物质的量,表示出转化率,据此比较;
C、题目中热化学方程式的意义为1molA完全反应,放热192 kJ,根据实际放出的热量计算参加反应的A的物质的量,进而表示出转化率进行判断;
D、N容器建立的平衡相当于恒温恒容下建立的平衡减小容器体积,据此确定.
解答 解:M容器保持恒容,N容器保持恒压,由于反应前后的气体系数和不等,所以两个平衡态也不一样,
A、要让M、N中平衡时A的体积分数一样,那么只能是M或N中,反应前后不论限度多少,A的体积分数始终为定值,假定反应的A为zmol,则:
A(g)+3B(g)?2C(g)
起始:x y
反应:z 3z 2z
平衡:x-z y-3z 2z
故平衡时A的体积分数为$\frac{x-z}{x+y-2z}$,A的体积分数始终为定值,则x=y,即x=y时,平衡时A气体在两容器中体积分数相等,故A正确;
B、x:y=1:2,即y=2 x,设反应中消耗掉amolA,则:
A(g)+3B(g)?2C(g)
初始(mol):x 2x 0
变化(mol):a 3a 2a
故A的转化率=$\frac{a}{x}$,B的转化率=$\frac{3a}{2x}$,则平衡时,M中的转化率:A<B,故B错误;
C、题目中热化学方程式的意义:若1molA完全反应,放热192 kJ,当M中放出热量172.8 kJ时,参加反应的A的物质的量为$\frac{172.8kJ}{192kJ}$×1mol=0.9mol,故A的转化率为$\frac{0.9}{x}$,故C错误;
D、x=1,y=3,由于反应后气体体积减小,N容器建立的平衡相当于恒温恒容下建立的平衡减小容器体积,压强增大,平衡正向移动,达到平衡后的转化率关系为:α(M)<α(N),故D正确.
故选AD.
点评 本题考查化学平衡的计算、平衡常数的计算等,难度较大,注意根据平衡常数判断平衡移动方向.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
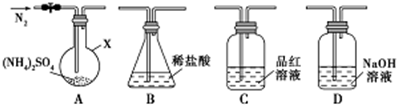
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该条件下反应的平衡常数为1.6×103 | |
| B. | 通常情况下,该反应一定能自发进行 | |
| C. | 题给条件下,SO2的转化率是80% | |
| D. | 当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
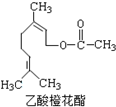 某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )
某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )| A. | ①②③ | B. | ①②④ | C. | ①②⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发生物质能替代化石燃料 | B. | 向高空排放金属冶炼产生的粉尘 | ||
| C. | 用催化转化技术处理汽车尾气 | D. | 大力推广生产和使用无氟冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠的水解反应:CO32-+H2O?HCO3-+OH- | |
| B. | 粗铜精炼时,与电源正极相连的是粗铜,电极反应式为:Cu-2e-═Cu2+ | |
| C. | 钢铁发生电化学腐蚀的负极反应式:Fe-2e-═Fe2+ | |
| D. | 碱性氢氧燃料电池负极反应式:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是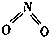 和
和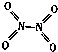 .实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
.实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11:2 | B. | 9:4 | C. | 1:1 | D. | 5:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com