
 (1)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
(1)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:| 生成物浓度的幂次方 |
| 反应物浓度的幂次方 |
| 19.76KJ |
| 49.4KJ/mol |
| 0.6+2.6+0.4+11.2 |
| 1+3 |
| 生成物浓度的幂次方 |
| 反应物浓度的幂次方 |
| 1.23×0.4 |
| 0.6×2.6 |
| 16g |
| 32g/mol |


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:

| A、①②③④⑤ | B、②③ |
| C、④⑤ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2FeCl3+Cu=2FeCl2+CuCl2 |
| B、Cl2+H2O═HCl+HClO |
| C、4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D、CaCO3+2HCl=CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
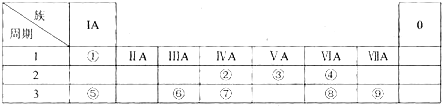

查看答案和解析>>
科目:高中化学 来源: 题型:
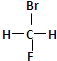 和
和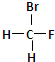 ②1H-、2H、3H+、D2 ③淀粉和纤维素 ④
②1H-、2H、3H+、D2 ③淀粉和纤维素 ④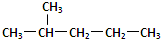 和
和 ⑤16O2、18O3 ⑥235U、238U
⑤16O2、18O3 ⑥235U、238U查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
 2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只通过物理变化即可提取海水中的溴单质 |
| B、海水蒸发制海盐的过程只发生化学变化 |
| C、从海水中可以得到NaCl,可电解NaCl溶液制备Na |
| D、利用海水、铝、空气的航标灯是将化学能转化为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com