
| A. | 碳钢与生铁主要成分相同,所以性能相同 | |
| B. | 镁铝合金可用于制造飞机、汽车等部件 | |
| C. | 铜合金具有优异的导电、导热性能,但耐腐蚀性能力较差 | |
| D. | 铝铁合金具有很高的熔点,能用于制造火箭外层材料. |
科目:高中化学 来源: 题型:选择题
| A. | Na和O2 | B. | NaOH和CO2 | C. | AlCl3和NaOH | D. | Na2O2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和铁 | B. | 镁和铜 | C. | 铝和镁 | D. | 锌和铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||||
| T | Q | W |
| A. | 工业电解熔融的 TW3制得单质T | |
| B. | 元素R和元素Q的最高正化合价相同 | |
| C. | 单核阴离子半径的大小顺序为r(Q)>r(W)>r(R) | |
| D. | 阴离子的还原性:Q<W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
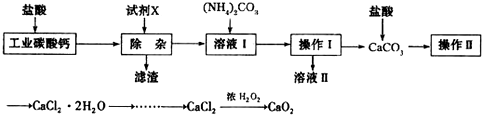
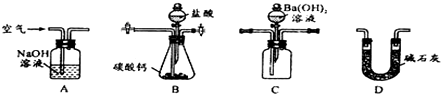
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C可用于文物的年代鉴定,14C与12C互为同素异形体 | |
| B. | 食用一定量的油脂能促进人体对某些维生素的吸收 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 服用铬含量超标的药用胶囊会对人体健康造成危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
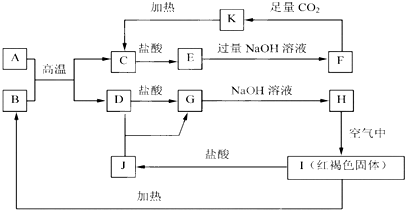
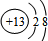 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com