
| A����Һ����ˮ�������c(OH��)=1��10��10mol/L |
| B����Һ��c(OH��)��c��NH3��H2O��=0.1mol/L |
| C����0.1mol/L ������������Ϻ�������Һ�У�c(Cl��)=c(NH4��)��c��NH3��H2O��=0.1mol/L |
| D��ԭ��Һ�м����������Ȼ�茶�����ˮϡ�ͣ���Һ�е�c(H��)������ |


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| | þ������ | ���� | ��ʼ�ķ�Ӧ���� | ����H2���� |
| �� | 0.24g | HCl�� 0.2 mol/L 100mL | ��1 | n1 |
| �� | 0.24g | CH3COOH��0.2 mol/L 100mL | ��2 | n2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ˮ��Һ�ĵ����������� |
| B��ϡ��Һ���ѵ�������Ӻ�δ����ķ��ӹ��� |
| C����ˮ��Һ��,���ڷ��� |
| D���ۻ�״̬ʱ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������������ʯ��Ӧ����������̼���� |
| B��pH = 3�Ĵ�����Һϡ��100����pH<5 |
| C�������£���������Һ��pH>7 |
| D�������£�0.1 mol��L��1������ҺpH="2.5" |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ������ | Na+��Ba2+��NH4+ |
| ������ | CO32����Cl����OH����SO42�� |
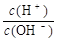 = ��
= ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Ũ����ͬʱ��pH��С˳��Ϊ��>��>�� |
| B������Ũ����ͬʱ��ϡ����ͬ������pH�仯����Ϊ�� |
| C�����ߵ�pH��Ϊ9ʱ�����ʵ���Ũ�ȵĴ�С��ϵΪ��>��>�� |
| D������Ũ����ͬʱ���ֱ����ͬ���ͬŨ�ȵ������pH�����Ǣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
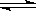 CH3COO��+ H+ ��ƽ����ϵ�У���������������ʹ����ĵ���̶Ⱥ���Һ��pH�������ǣ� ��
CH3COO��+ H+ ��ƽ����ϵ�У���������������ʹ����ĵ���̶Ⱥ���Һ��pH�������ǣ� ��| A��NH4Cl���� | B��CH3COONa | C��NH3��H2O | D��Zn�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com