
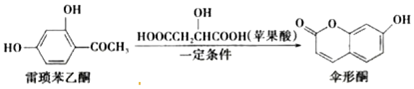
| A. | 雷琐苯乙酮有两种含氧官能团 | |
| B. | 1 mol伞形酮与足量 NaOH溶液反应,最多可消耗 2 mol NaOH | |
| C. | 伞形酮难溶于水 | |
| D. | 雷琐苯乙酮和伞形酮都能跟 FeCl3溶液发生显色反应 |
分析 A.雷琐苯乙酮含有羟基、羰基;
B.伞形酮含有酯基、酚羟基,而酯基是羧酸与酚形成的,水解得到羧基、酚羟基,酚羟基、羧基都可与氢氧化钠反应;
C.伞形酮含有酯基与酚羟基,具有酯与酚的性质;
D.雷梭苯乙酮和伞形酮都含有酚羟基,均能跟FeCl3溶液发生显色反应.
解答 解:A.雷琐苯乙酮含有羟基、羰基2种官能团,故A正确;
B.伞形酮含有酯基、酚羟基,而酯基是羧酸与酚形成的,水解得到羧基、酚羟基,酚羟基、羧基都可与氢氧化钠反应,1mol伞形酮与足量NaOH溶液反应,最多可消耗3mol NaOH,故B错误;
C.伞形酮含有酯基与酚羟基,具有酯与酚的性质,伞形酮难溶于水,故C正确;
D.雷梭苯乙酮和伞形酮都含有酚羟基,均能跟FeCl3溶液发生显色反应,故D正确.
故选B.
点评 本题考查有机物的结构性质,为高频考点,把握官能团与性质的关系为解答的关键,选项B解答的易错点,注意手性碳原子的判断,题目难度中等.


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:解答题
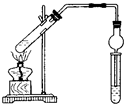 用图所示实验装置制取乙酸乙酯.回答以下问题:
用图所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Cl-、Al3+、SO42- | B. | Ba2+、Na+、SO42-、MnO4- | ||
| C. | K+、Cl-、HCO3-、CH3COO- | D. | Cu2+、NH4+、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、Cl- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | H+、K+、HCO3-、Cl- | D. | Mg2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 向Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 硫代硫酸钠溶液中加入硫酸:S2O32-+6H++2SO42-═4SO2↑+3H2O | |
| D. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I->Fe2+>Cl->SO2 | B. | Cl->Fe2+>SO2>I- | C. | Fe2+>I->Cl->SO2 | D. | SO2>I->Fe2+>Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同族元素的氧化物不可能形成不同类型的晶体 | |
| B. | SiO2晶体网状结构的最小的环上,Si和O原子数之比为1:2 | |
| C. | 满足难溶于水,熔点高,固体不导电,熔化时导电的晶体为离子晶体 | |
| D. | 同分异构体中,燃烧热数值越大,该物质越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com