
普通玻璃、钢铁和玻璃钢是三种不同的材料,它们在性能方面差别很大。请根据学过的知识,回答下面问题。
(1)普通玻璃的成分是____________________________________________。
(2)铁在人类的生产和生活中有着十分重要的应用。铁的应用,经历了________到________到________的演变过程。
(3)某种复合材料具有耐高温、强度高、导电性好、导热性好的特点,估计该复合材料的基体和增强体材料可能分别是( )
A.金属;碳纤维 B.陶瓷;SiO2
C.合成树脂;SiO2、Al2O3、MgO D.合成树脂;碳纤维
解析: (1)玻璃是常见的硅酸盐材料。制普通玻璃的主要原料是纯碱、石灰石和石英。生产玻璃时,把原料粉碎后按一定比例混合后,放入玻璃熔炉中加强热,石灰石与石英反应生成硅酸钙和二氧化碳,纯碱与石英反应生成硅酸钠和二氧化碳,但原料中石英是过量的,所以普通玻璃的成分为硅酸钙、硅酸钠、二氧化硅。(2)由铁矿石炼得的生铁虽然硬度很大,但较脆且不易加工,人们就想办法降低生铁中的碳元素,调节其中的硅、锰等元素,将铁转化为钢,大大改善了其性能。但是,钢铁很容易锈蚀,于是不锈钢应运而生。因此,铁的应用经历了“铁———普通钢——不锈钢等特种钢”的演变过程。(3)复合材料兼具有基体和增强体的优点,据此可判断,应该为金属和碳纤维的复合材料。
答案: (1)硅酸钙、硅酸钠、二氧化硅
(2)铁 普通钢 不锈钢 (3)A


科目:高中化学 来源: 题型:
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
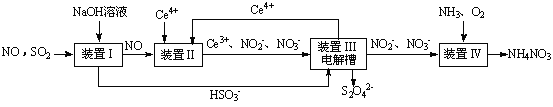
(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。
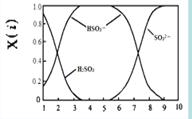
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
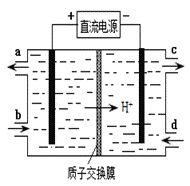
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用甲苯生产对羟基苯甲酸乙酯(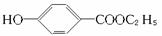 ),其过程如下:
),其过程如下:

据合成路线填写下列空白:
(1)有机物A的结构简式:____________________,B的结构简式:____________________。
(2)反应④属于____________反应,反应⑤属于______________反应。
(3)③和⑥的目的是______________________________________________。
(4)写出反应⑥的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在
下加热反应制得:
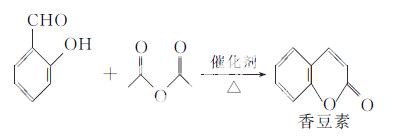
以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去):
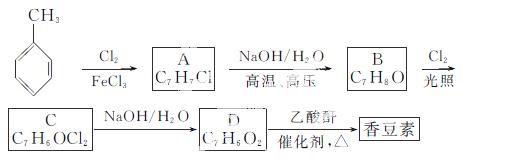
已知以下信息:
①A中有五种不同化学环境的氢;
②B可与FeCl3溶液发生显色反应;
③同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基。
请回答下列问题:
(1)香豆素的分子式为__________;
(2)由甲苯生成A的反应类型为__________,A的化学名称为__________;
(3)由B生成C的化学反应方程式为__________________________________;
(4)B的同分异构体中含有苯环的还有__________种,其中在核磁共振氢谱中只出现四组峰的有________种;
(5)D的同分异构体中含有苯环的还有________种,其中:
①既能发生银镜反应,又能发生水解反应的是__________(写结构简式);
②能够与饱和碳酸氢钠溶液反应放出CO2的是__________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关材料的说法不正确的是( )
A.航天飞机使用的隔热陶瓷瓦为复合材料
B.复合材料由基体和增强体组成
C.复合材料既保持原有材料的特点,又有优于原材料的特性
D.纯金属的性能一般优于合金
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g)2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示,下列有关说法一定正确的是( )
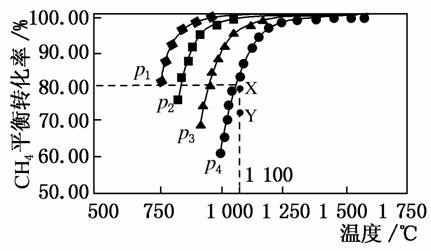
A.上述反应的ΔH>0
B.压强p1>p2>p3>p4
C.1 100 ℃时该反应的平衡常数为64 mol2·L-2
D.压强为p4时,在Y点:v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 3 | 8 |
| 总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 |
| 时间t/h | 16 | 20 | 25 | 30 | |
| 总压强p/100 kPa | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为________,平衡时A的转化率为________,列式并计算反应的平衡常数K________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=________mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下表,下列说法正确的是 ( )
CH3OCH3(g)+H2O(g);ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下表,下列说法正确的是 ( )
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.8 | 1.24 | 1.24 |
A. 平衡后升高温度,平衡常数>400
B. 平衡时,c(CH3OCH3)=1.6 mol·L-1
C. 平衡时,反应混合物的总能量减少40 kJ
D. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于实验数据或操作的说法正确的是
A.某同学称得质量为5.4 g的NaOH固体
B.某学生用量筒准确量取盐酸2.12 mL
C.将pH试纸润湿,用玻棒蘸取待测液点到上面然后与标准比色卡对照
D.用酒精萃取碘水中的碘,在分液漏斗中静置分层后分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com