
【题目】制取氯化铁粉末所需装置如下,已知氯化铁粉末很容易吸水生成结晶化合物:FeCl3+6H2O=FeCl3·6H2O。
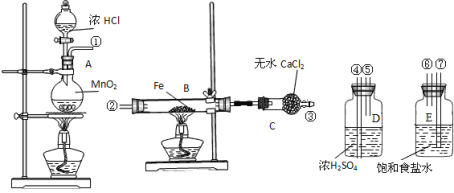
(1)按照气体流向从左到右顺序连接仪器应是①接_____,____接______,____接_______。
(2)烧瓶A中发生的反应_________________,B中反应的现象是____________。
(3)容器D的作用是_______,容器E的作用是_________。
(4)实验时应先点燃__处(填“A”或“B”)的酒精灯,理由是___________________________。
(5)这套实验装置是否完整?___(填“是”或“否”),若不完整,还须补充___________装置(若第一问填“是”,则此问不需要作答)。
【答案】⑦ ⑥ ④ ⑤ ② MnO2+4HCl(浓) ![]() MnCl2+ Cl2+2H2O 剧烈燃烧,产生棕褐色烟 吸收水分 吸收氯气中的氯化氢气体 A 使制取的Cl2排尽装置内的空气,防止铁被空气中的氧气氧化 否 装有氢氧化钠溶液的烧杯(或尾气吸收)
MnCl2+ Cl2+2H2O 剧烈燃烧,产生棕褐色烟 吸收水分 吸收氯气中的氯化氢气体 A 使制取的Cl2排尽装置内的空气,防止铁被空气中的氧气氧化 否 装有氢氧化钠溶液的烧杯(或尾气吸收)
【解析】
制取无水FeCl3,由实验装置可知,A中发生MnO2+4HCl(浓) ![]() MnCl2+ Cl2+2H2O,后面连接E除去氯气中的HCl,再连接D干燥氯气,然后连接B,B中发生3Cl2+2Fe
MnCl2+ Cl2+2H2O,后面连接E除去氯气中的HCl,再连接D干燥氯气,然后连接B,B中发生3Cl2+2Fe![]() 2FeCl3,C中可吸收水,防止空气中水进入B中,该实验还需要尾气处理装置,以此解答。
2FeCl3,C中可吸收水,防止空气中水进入B中,该实验还需要尾气处理装置,以此解答。
(1)由上述分析可知,装置为A→E→D→B→C,按照气体流向从左到右的顺序连接仪器的接口为①接⑦,⑥接④,⑤接,故答案为:⑦;⑥;④;⑤;②;
(2)A装置的烧瓶中发生反应的离子方程式为MnO2+4HCl(浓) ![]() MnCl2+ Cl2+2H2O,B装置中发生反应的化学方程式为3Cl2+2Fe
MnCl2+ Cl2+2H2O,B装置中发生反应的化学方程式为3Cl2+2Fe![]() 2FeCl3,现象为:剧烈燃烧,产生棕褐色烟;故答案为:MnO2+4HCl(浓)
2FeCl3,现象为:剧烈燃烧,产生棕褐色烟;故答案为:MnO2+4HCl(浓) ![]() MnCl2+ Cl2+2H2O;剧烈燃烧,产生棕褐色烟;
MnCl2+ Cl2+2H2O;剧烈燃烧,产生棕褐色烟;
(3)D装置的作用是吸收水分;E装置的作用是吸收氯气中的氯化氢气体,故答案为:吸收水分;吸收氯气中的氯化氢气体;
(4)实验开始时,应先点燃 A处的酒精灯,使制取的Cl2排尽装置内的空气,防止铁被空气中的氧气氧化,故答案为:A;使制取的Cl2排尽装置内的空气,防止铁被空气中的氧气氧化;
(5)这套实验装置不完整,还须补充装有氢氧化钠溶液的烧杯(或尾气吸收),故答案为:否;装有氢氧化钠溶液的烧杯(或尾气吸收)。


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】某温度下,HNO2和CH3COOH的电离常数分別为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
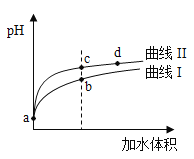
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中![]() 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如下图所示,有关其性质叙述不正确的是
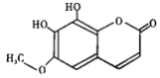
A. 1mol 该化合物最多能与3 mol NaOH 反应 B. 该有机物分子式为C10H8O5
C. 该有机物能发生加成、氧化、取代等反应 D. 分子中有四种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____________________(填字母)。
A.c(H+) B.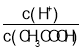 C.c(H+)c(OH﹣) D.
C.c(H+)c(OH﹣) D.![]() E.
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:______________________。
(4)25℃时,将a mol/L的醋酸与等浓度的氢氧化钠等体积混合,反应后溶液中的离子浓度由大到小关系是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.C6H14的同分异构体共有5种
B.H2O、H2O2互为同素异形体
C.H2、CH4、C2H6互为同系物
D.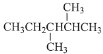 的名称为:3,4—二甲基戊烷
的名称为:3,4—二甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1L0.1mol·L-1的NaOH溶液中缓慢通入CO2,溶液的pH随CO2的物质的量变化如下图所示(实验过程中溶液体积变化忽略不计),下列说法正确的是
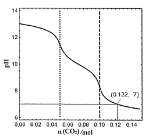
A.在整个过程中,溶液中一定不存在![]()
B.![]() 时,
时,![]()
C.当![]() 时,溶液中不存在H2CO3分子
时,溶液中不存在H2CO3分子
D.当![]() 时,一定有
时,一定有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是

A. 浓H2SO4B. NaOH溶液C. NaCl溶液D. Ca(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是只含碳、氢、氧三元素的有机物,是高效的抗疟药,为无色针状晶体,易溶于乙醚中,在水中几乎不溶,熔点为156~157℃,已知乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础,以乙醚浸取法的主要工艺如图所示:
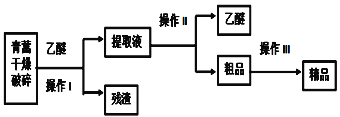
回答下列问题:
(1)选用乙醚浸取青蒿素的原因是______。
(2)操作I需要的玻璃仪器主要有:烧杯、玻璃棒和________ ,操作Ⅱ的名称是__________,操作Ⅲ利用青蒿素和杂质在同一溶剂中的溶解性差异及青蒿素溶解度随温度变化较大的原理提纯,这种方法是______________。
(3)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成,如图所示的是用燃烧法确定青蒿素分子式的装置:
A.  B.
B. 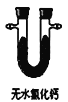 C.
C. 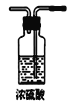 D.
D.  E.
E. 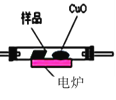
①按上述所给的测量信息,装置的连接顺序应是_____________。(装置可重复使用)
②青蒿素样品的质量为28.2g,用连接好的装置进行试验,称得A管增重66g,B管增重19.8g,则测得青蒿素的最简式是_____________。
③要确定该有机物的分子式,还必须知道的数据是_________,可用__________仪进行测定。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如图,关于绿原酸判断正确的是( )
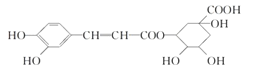
A.1mol 绿原酸与足量 NaHCO3 溶液反应,生成 3molCO2 气体
B.1mol 绿原酸与足量 Na 反应,最多消耗 6molNa
C.1mol 绿原酸与足量 NaOH 溶液反应,最多消耗 3molNaOH
D.绿原酸水解产物均可以与 FeCl3 溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com