
| A. | 正极附近的 SO42-离子浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 溶液的pH逐渐变小 | |
| D. | 铜片上有H2逸出 |
分析 铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极;负极上锌失电子生成锌离子,正极上氢离子得电子生成氢气;溶液中阴离子向负极移动,阳离子向正极移动;根据溶液中氢离子浓度的变化判断溶液PH值的变化.
解答 解:A、该原电池放电时,溶液中阴离子向负极移动,阳离子向正极移动,所以正极附近的S042-离子浓度逐渐减小,故A错误;
B、铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极;原电池放电时,电子从负极锌沿导线流向正极铜,故B错误;
C、该原电池中正极上氢离子得电子生成氢气,导致溶液中氢离子浓度降低,溶液的PH值增大,故C错误;
D、铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极,正极上氢离子得电子生成氢气,电极反应式为:2H++2e-=H2↑,故D正确.
故选:D.
点评 本题考查了原电池原理,难度不大,易错点为:判断溶液中阴阳离子的移动方向.


科目:高中化学 来源: 题型:解答题
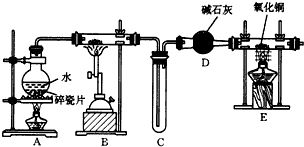
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


| 时间 (s) 浓度 mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 可逆反应达到化学平衡时,正、逆反应速率都为零 | |
| D. | 化学反应中,纯液体物质不能计算其速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石网状结构中,由共价键形成的碳原子环其中最小环有6个碳原子 | |
| B. | 在氯化钠的晶体中,每个Na+或Cl-的周围都紧邻6个Cl-或Na+ | |
| C. | 在氯化铯晶体中,每个Cs+周围都紧邻8个Cl-,每个Cl-周围也紧邻8个Cs+ | |
| D. | 在干冰的晶体中,每个CO2分子周围都紧邻4个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①②③⑤ | B. | ②③④① | C. | ④③⑤① | D. | ⑤③④① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
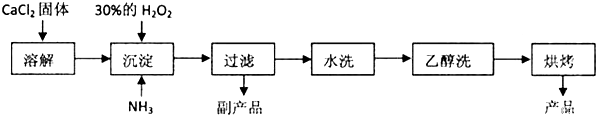
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com