
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?枣庄二模)物质在水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值(25℃):
(2012?枣庄二模)物质在水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值(25℃):
| ||
| ||
| 10-9 |
| x-10-2 |
| 10-9 |
| x-10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
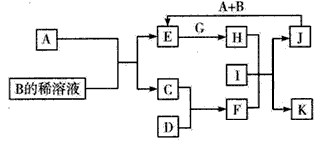
科目:高中化学 来源:2012届贵州省凯里一中高三第二次月考理综合测试(化学部分) 题型:填空题
(16分)下图是中学常见物质间的转化关系。已知:
a.A为淡黄色固体,B为导致“温室效应”的主要物质;
b.E为常见金属,J为红褐色沉淀;
c.G在实验室中常用于检验B的存在;
d.L是一种重要的工业原料,常用于制造炸药,浓溶液若保存不当常呈黄色。
回答下列问题:
(1)A的电子式为 ;B分子属于 分子(极性、非极性);
(2)反应①的化学方程式为 ,
反应②的离子方程式为 ,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为 L。
(4)检验K中阳离子常用的方法是 。
(5)L浓溶液的保存方法是 。
查看答案和解析>>
科目:高中化学 来源:枣庄二模 题型:问答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com