
某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g)△H<0.下图表示该反应的速率(υ)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是()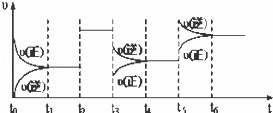
A. t3时降低了温度
B. t5时增大了压强
C. t2时加入了催化剂
D. t4~t5时间内转化率一定最低
考点: 化学平衡的影响因素.
分析: A.t3时改变条件,正逆反应速率均减小,且逆反应速率大于正反应速率;
B.t5时改变条件,正逆反应速率增大,且逆反应速率大于正反应速率;
C.由图可知,t2时改变条件,正逆反应速率增大且相等;
D.催化剂对平衡移动无影响,t3~t4时间内平衡逆向移动,转化率减小,t5~t6时间内平衡逆向移动,转化率继续减小.
解答: 解:A.t3时改变条件,正逆反应速率均减小,且逆反应速率大于正反应速率,若降低温度,平衡正向移动,与图象不符,故A错误;
B.t5时改变条件,正逆反应速率增大,且逆反应速率大于正反应速率,若增大压强,平衡逆向移动,与图象不符,故B错误;
C.由图可知,t2时改变条件,正逆反应速率增大且相等,若增大压强平衡发生移动,则t2时加入了催化剂,故C正确;
D.催化剂对平衡移动 无影响,t3~t4时间内平衡逆向移动,转化率减小,t5~t6时间内平衡逆向移动,转化率继续减小,显然t5~t6时间内转化率比t4~t5时间内转化率低,故D错误;
无影响,t3~t4时间内平衡逆向移动,转化率减小,t5~t6时间内平衡逆向移动,转化率继续减小,显然t5~t6时间内转化率比t4~t5时间内转化率低,故D错误;
故选C.
点评: 本题考查化学反应速率的影响因素及图象,明确反应为放热反应且为体积缩小的反应结合平衡移动与速率大小的关 系即可解答,题目难度中等.
系即可解答,题目难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
固体NH4Br置于密闭容器中,某温度下发生反应:NH4Br(s)⇌NH3(g)+HBr(g),2HBr(g)⇌Br2(g)+H2(g),2min后测知H2的浓度为0.5mol•L﹣1,HBr的浓度为4mol•L﹣1,若上述反应速率用v(NH3)表示,则下列速率正确的是()
A. 0.5mol•L﹣1•min﹣1 B. 2.5mol•L﹣1•min﹣1
C. 2mol•L﹣1•min﹣1 D. 1.25mol•L﹣1•min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 凡是放热反应都是自发的,由于吸热反应都是非自发的
B. 自发反应一定是熵增大,非自发反应一定是熵减少或不变
C. 自发反应在恰当条件下才能实现
D. 自发反应在任何条件下都能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)⇌C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/℃ 700 900 830 1000 1200
平衡常数 1.7 1.1 1.0 0.6 0.4
回答下列问题:
(1)该反应的△H 0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,若反应经一段时间后,达到平衡时A的转化率为80%,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率会 (填“变大”、“变小”或“不变”)
(3)若保持容器的容积不变,则该反应达到化学平衡状态的依据是 (填序号).
a.单位时间里生成B和D的物质的量相等
b.气体的密度不随时间改变
c.容器内压强保持不变
d.混合气体的平均摩尔质量保持不变
(4)1200℃时反应C(g)+D(g)⇌A(g)+B(g)的平衡常数的 值为 .
值为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用化学平衡移动原理解释的是()
A. 合成氨工业中采用高压条件
B. 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C. 用排饱和食盐水的方法收集Cl2
D. 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室进行中和热测定的实验时除需要大烧杯(500mL)、小烧杯(100mL)外,所用的其他仪器和试剂均正确的一组是()
A. 0.50 mol•L﹣1盐酸,0.50 mol•L﹣1NaOH溶液,100 mL量筒1个
B. 0.50 mol•L﹣1盐酸,0.55 mol•L﹣1NaOH溶液,100 mL量筒2个
C. 0.50 mol•L﹣1盐酸,0.55 mol•L﹣1NaOH溶液,50 mL量筒1个
D. 0.50 mol•L﹣1盐酸,0.55 mol•L﹣1NaOH溶液,50 mL量筒2个
查看答案和解析>>
科目:高中化学 来源: 题型:
(4)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=﹣41.3kJ•mol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度e.分离出二甲醚.
查看答案和解析>>
科目:高中化学 来源: 题型:
在研究金属钠与水的反应实验中,反应过程中所观察到的实验现象与金属钠的下列性质无关的是()
A. 熔点低 B. 密度小 C. 硬度小 D. 化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用如图中的装置可以实现该反应.
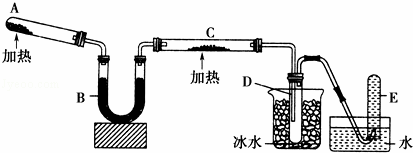
回答下列问题:
(1)A中发生反应的化学方程式是 .
(2)B中加入的干燥剂是(填序号)③①浓硫酸 ②无水氯化钙 ③碱石灰
(3)能证明氨与氧化铜反应的现象是①C中 ,②D中有无色液体生成设计实验检验D中无色液体的成分:取少量 粉末,现象为 .
(4)写出氨气与氧化铜反应化学方程式 若收集到2.24L(STP)氮气,计算转移电子数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com