
| A. | Na+、Cu2+、NO3-、CO32- | B. | Ba2+、K+、Cl-、HCO3- | ||
| C. | Fe2+、Na+、SO42-、NO3- | D. | Mg2+、NH4+、SO42-、Cl- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,结合信息可知与酸反应生成气体、与碱反应生成沉淀的来解答.
解答 解:A.Cu2+、CO32-结合生成沉淀,不能共存,故A不选;
B.该组离子之间不反应,可大量共存,且H+、HCO3-反应生成气体,Ba2+、OH-、HCO3-反应生成沉淀,故B选;
C.该组离子之间不反应,可大量共存,且H+、Fe2+、NO3-反应生成NO气体,Fe2+、OH-反应生成沉淀,故C选;
D.该组离子之间不反应,可大量共存,但不能与酸反应生成气体,故D不选;
故选BC.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与任何酸、碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富,仅次于铁 | |
| D. | 工业上通常用钠与铝盐溶液反应来制备铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6a g | B. | (a-1.6)g | C. | (a-3.2)g | D. | (2a-3.2)g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲苯含有6nA个C-H键 | |
| B. | 18 g H2O含有10nA个质子 | |
| C. | 标准状况下,2.24 L CCl4中含有的C-Cl键数为0.4NA | |
| D. | 常温下,56 g铁片投入足量浓H2SO4中生成nA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

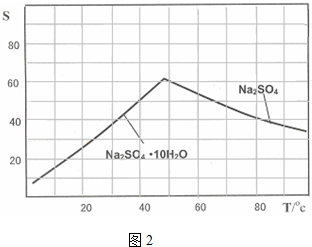
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
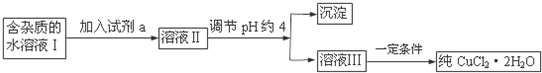
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 4.7 |
| 完成沉淀pH | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 | |
| B. | 二氧化硫具有漂白、杀菌性能,可在食品生产中大量使用 | |
| C. | 浓硫酸具有吸水性,可以用来干燥氨气 | |
| D. | 次氯酸钠具有强氧化性,可用于配制消毒液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都增大,平衡不发生移动 | |
| B. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| C. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com