
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从3 min到9 min,υ(CO2)=______mol·L-1·min-1
(2)能说明上述反应达到平衡状态的是____________(填编号)
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1 mol H2,同时生成1 mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO2的转化率为________%
(4)平衡混合气体中CO2(g)和H2(g)的质量之比是____________。
(5)第3 min时υ正(CH3OH)___________第9 min时υ逆(CH3OH)(填“>”、“<”或“=”)。
【答案】0.042 BD 75 22:3 >
【解析】
(1)根据v=![]() 计算;
计算;
(2)反应达到平衡时任何物质的物质的量、浓度、含量等保持不变,据此判断;
(3)根据转化率=![]() ×100%计算;
×100%计算;
(4)根据加入的反应物的物质的量及物质反应转化关系判断平衡时两种气体的物质的量关系,然后计算二者的质量之比;
(5)第9 min时反应达到平衡,此时υ正(CH3OH)=υ逆(CH3OH),反应从在反应方向开始。
(1)根据图示可知:从3 min到9 min,CO2的浓度从0.5 mol/L变为0.25 mol/L,故用CO2浓度变化表示的反应速率v(CO2)=![]() =0.042 mol/(L·min);
=0.042 mol/(L·min);
(2)反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)在1 L的恒容密闭容器中进行,正反应是气体体积减小的反应,
CH3OH(g)+H2O(g)在1 L的恒容密闭容器中进行,正反应是气体体积减小的反应,
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点),由于CO2与CH3OH的浓度还在发生变化,说明反应未达到平衡,A不符合题意;
B.反应在恒容密闭容器中进行,若混合气体的压强不随时间的变化而变化,说明气体的物质的量不变,反应达到平衡状态,B符合题意;
C.单位时间内生成1 mol H2,就会消耗![]() mol CH3OH,同时生成1 mol CH3OH,说明反应正向进行,未达到平衡状态,C不符合题意;
mol CH3OH,同时生成1 mol CH3OH,说明反应正向进行,未达到平衡状态,C不符合题意;
D.气体的质量不比,混合气体的平均相对分子质量不随时间的变化而变化,说明气体的物质的量不变,反应达到平衡状态,D符合题意;
故合理选项是BD;
(3)根据图象可知:在反应开始时CO2浓度是1.00 mol/L,平衡时浓度为0.25 mol/L,所以CO2的平衡转化率=![]() ×100%=
×100%=![]() ×100%=75%;
×100%=75%;
(4)反应开始时加入1 mol CO2和3 mol H2,根据方程式CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)可知:CO2和H2反应消耗的物质的量的比是1:3,因此平衡时CO2(g)和H2(g)的物质的量的比也是1:3,所以平衡时m(CO2):m(H2)=(1 mol×44 g/mol):(3 mol×2 g/mol)=22:3;
CH3OH(g)+H2O(g)可知:CO2和H2反应消耗的物质的量的比是1:3,因此平衡时CO2(g)和H2(g)的物质的量的比也是1:3,所以平衡时m(CO2):m(H2)=(1 mol×44 g/mol):(3 mol×2 g/mol)=22:3;
(5)反应从正反应方向开始,随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大,当到第9 min时反应达到平衡,此时υ正(CH3OH)=υ逆(CH3OH),因此第3 min时υ正(CH3OH)>第9 min时υ逆(CH3OH)。


科目:高中化学 来源: 题型:
【题目】我国古代“药金”的冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A. “药金”实质上是铜锌合金
B. 冶炼炉中炉甘石直接被木炭还原为锌
C. 用王水可区别黄金和“药金”
D. 用火焰灼烧不能区别黄金和药金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.某盐溶液呈酸性,该盐不可能是弱酸与弱碱反应生成的盐
B.向氨水中不断通入CO2气体,溶液中c(OH-)/c(NH3·H2O)相应减小
C.CH3Cl(g)+Cl2(g) ![]() CH2Cl2(l)+HCl(g);常温下能自发进行,则该反应的△H>0
CH2Cl2(l)+HCl(g);常温下能自发进行,则该反应的△H>0
D.硫酸工业中的反成,2SO2(g)+O2(g)![]() 2SO3(g)△H<0,采用500℃左右的高温主要是为了加快反应速率。
2SO3(g)△H<0,采用500℃左右的高温主要是为了加快反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或现象不能用平衡移动原理解释的是
A. 卤化银沉淀的转化

B. 配制FeCl3溶液
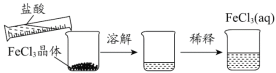
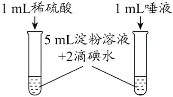
C. 淀粉在不同条件下水解
D. 探究石灰石与稀盐酸在密闭环境下的反应
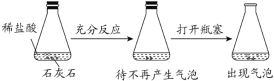
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是
CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是
A.v(CO)=v(H2O)时,反应达到平衡状态
B.保持体积不变,充入少量He气体使体系压强增大,反应速率一定增大
C.其他条件不变,仅将容器的体积缩小一半,反应速率加快
D.其他条件不变,适当增加C(s)的质量会使反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,工业上由氧化铝与焦炭在氮气流中高温制得,产品中常含有Al4C3、C和Al2O3等杂质。某实验小组为测定a g工业氮化铝样品中AlN的质量及Al4C3的质量分数,设计了如下装置,已知装置B、C、D中的药品均足量。

已知:①AlN和Al4C3均能与水反应,分别生成NH3和CH4。②CH4能与CuO发生反应:CH4+4CuO![]() 4Cu+CO2+2H2O。
4Cu+CO2+2H2O。
(1)写出锥形瓶中发生反应的化学方程式。AlN与H2O反应:__________;Al4C3与H2O反应:____________。
(2)有下列操作步骤:①缓缓鼓入一定量的N2;②称量C和D(酒精灯和铁架台等除外)的质量,按顺序组装仪器,检查装置的气密性,将样品放入锥形瓶中;③点燃D处酒精灯;④再次称量C和D的质量;⑤从分液漏斗缓缓滴入水,直到不再产生气体时为止;⑥再次缓缓鼓入一定量的N2。正确的操作顺序是_________。
(3)C的作用是吸收氨气,则C中所盛试剂的最佳选择是________(填代号)。
A.蒸馏水 B.浓硝酸C.浓盐酸 D.浓硫酸
(4)A中反应结束后,还要通入一段时间的N2至D中固体恢复到室温,其目的是_______(写两条)。
(5)实验结束后,测得反应后D中固体质量减少m g,C中增加n g,则a g样品中AlN的质量为________g,Al4C3的质量分数为________×100%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某无结晶水的正盐X(仅含有两种短周期元素)的组成和性质,设计并完成下列实验。(气体体积已转化为标准状况下的体积)
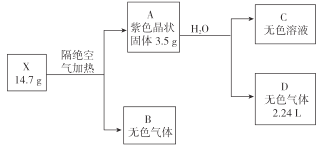
已知:B是空气的主要成分之一;C是一种强碱,且微溶于水 ,载人宇宙飞船内常用含 C的过滤网吸收宇航员呼出的CO2,以净化空气;D遇湿润的红色石蕊试纸变蓝。
(1)X的化学式为 __________________ 。
(2)图中B的组成元素在元素周期表中的位置是______________。
(3)A的电子式为 ____________。
(4)X受热分解转变成 A 和 B 的化学反应方程式为 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)丙烷(C3H8)是一种价格低廉的常用燃料,其主要成分是碳和氢两种元素,燃烧后只有二氧化碳和气态水,不会对环境造成污染。已知1 g丙烷完全燃烧放出50.45kJ的热量。丙烷在室温下燃烧的热化学方程式为____。
(2)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
则2CH4(g)+ O2(g)=2CO(g)+4H2(g)ΔH=___;
(3)在密闭容器中充入A(g)和B(g),它们的初始浓度均为2mol·L-1,在一定条件下发生反应:A(g)+B(g)![]() 2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
①该反应的平衡常数的表达式为____。
②A的转化率为_____。
③若升温至T2时,此反应的平衡常数为1,判断该反应ΔH___0(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子PMMA是迄今为止合成透明材料中质地最优异、价格又比较适宜的品种。其中一种合成路线如图:
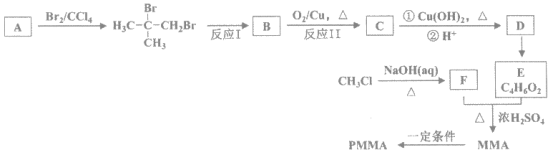
(1)A的分子式是__________。
(2)反应II的化学方程式是____________________。
(3)由MMA制取高分子PMMA的化学方程式是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com