

 ,10mL的混合溶液中硫酸是0.04mol,硝酸是0.02mol,所以氢离子的物质的量是0.1mol。硝酸和铜反应的离子方程式为
,10mL的混合溶液中硫酸是0.04mol,硝酸是0.02mol,所以氢离子的物质的量是0.1mol。硝酸和铜反应的离子方程式为

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.CO2的摩尔质量为44g |
| B.1 mol CO2的质量为44g/mol |
| C.CO2的摩尔质量等于CO2的相对分子质量 |
| D.NA个CO2的质量与CO2的相对分子质量在数值上相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.54g H218O中含有电子总数为30NA个 |
| B.11.2L H2中含有的电子数为NA个 |
| C.23gNa+含有的最外层电子数为NA个 |
| D.16g氧气和16g臭氧含有的核外电子总数均为8NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.1:2 | C.2:1l | D.2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为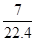 NA NA |
| B.1 mol甲基(—CH3)所含的电子总数为7NA |
| C.0.5 mol 1, 3-丁二烯分子中含有C=C双键数为 NA |
| D.1 mol碳正离子(CH3+)所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,11.2L的己烷所含的分子数为0.5NA |
| B.乙醇和乙醚互为同分异构体 |
| C.1 mol甲基(—CH3)所含的电子总数为10NA |
| D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③ | C.①② | D.①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com