
、在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象
和结论一定正确的是 ( )
A.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
B.加入有色布条,一会儿有色布条褪色。说明溶液中有Cl2分子存在
C.加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明氯水中有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
科目:高中化学 来源: 题型:
(1)利用H2S废气来制取氢气的方法有多种。
①高温热分解法。
已知:H2S(g) H2(g)+S2(g)
H2(g)+S2(g)
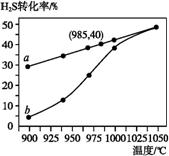
在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L -1测定H2S的
-1测定H2S的 转化率,结果见下图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不
转化率,结果见下图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不 同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985 ℃时H2S按上述反应分解的平衡常数K= ;说明温度升高,曲线b向曲线a逼近的原因: 。
同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985 ℃时H2S按上述反应分解的平衡常数K= ;说明温度升高,曲线b向曲线a逼近的原因: 。
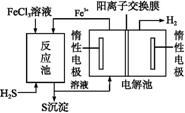
②电化学法。
该法制氢过程的示意图如下。反应池中反应物的流向采用气、液逆流方式,其目的是 ;反应池中发生反应的化学方程式为 。反应后的溶液进入电解池,电解总反应的离子方程式为 。
(2)氯碱工业中电解饱和食盐水的原理示意图如下图所示。
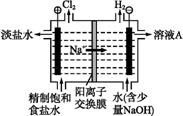
①溶液A的溶质是 ;
②电解饱和食盐水的离子方程式是 ;
③电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机物的一氯取代物的同分异构体数目相等的是( )
①2,3,4三甲基己烷 ②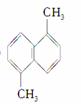 ③2,3,4三
③2,3,4三
甲基戊烷 ④间甲基乙苯
A.①② B.②③
C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计和结论相符的是
A.加入NaOH溶液并加热,能产生使湿润红色石蕊试纸变蓝气体,则一定含有NH4+
B.将SO2通入溴水,溴水褪色,说明SO2具有漂白性
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D.在含FeC12杂质的FeCl3溶液中通入足里C12后,充分加热除去过量的C12,即可得到较纯净的FeC13溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋中资源丰富,以海水为原料可制得一系列产品,如下图所示:

下列有关说法正确的是
A.第①步除去粗盐SO42-、Ca2+、Mg2+、Fe3+等杂质离子,加入的药品顺序为:
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.将第②步结晶出的MgCl2 6H2O在空气中加热分解制备无水MgCl2
6H2O在空气中加热分解制备无水MgCl2
C.在第③④⑤步中溴元素均被氧化
D.电解饱和食盐水时,在阴极区生成NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用0.50 mol·L- 1 NaOH溶液和0.50mol·L- 1 。1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol·L- 1 硫酸溶液
(1)若配制250 mL硫酸溶液,则须用量筒量取密度为1.84 g·cm- 3、质量分数为
98%的浓硫酸 mL。
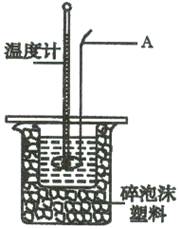
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如右图所示:
(2)仪器A的名称为 ;
(3)装置中碎泡沫塑料的作用是 ;
(4)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol- 1)
;
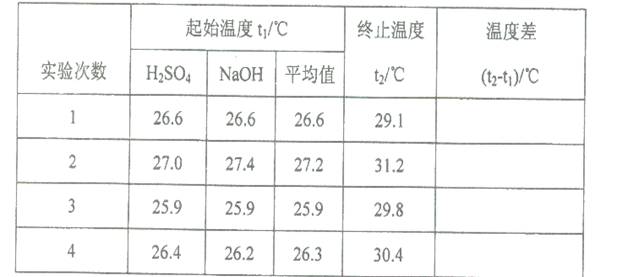
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的温度差平均值为 ℃;
②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c= 4.18 J·(g·℃)- 1 。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol- 1 有偏差,产生此实验偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
|
时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_______________________________________。(提示:H2O2的密度可认为近似相等)。
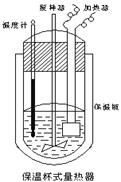 (Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是
150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似
为1g·mL-1。
(1)试求CH3COOH的中和热△H= 。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列判断正确的是( )
A.酸酐一定是氧化物 B.晶体中一定存在化学键
C.碱性氧化物一定是金属氧化物 D.正四面体分子中键角一定是109o28′
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系。下列有关物质的推断正确的是
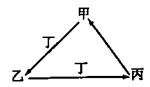
A.若甲为N2,则丁可能是O2
B.若甲为Fe,则丁可能是Cl2
C.若甲为AlCl3,则丁可能是NH3
D. 若甲为NaHCO3,则丁可能是HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com