
| A. | 平衡时,物质的量之比n(A):n(B):n(C)=2:11:4 | |
| B. | x值等于3 | |
| C. | A的转化率为20% | |
| D. | B的平均反应速率为0.4 mol/(L•min) |
分析 根据三段式:
A(g)+xB(g)?2C(g)
起始量(mol):1 3 0
转化量(mol):0.2 0.2x 0.4
平衡量(mol):0.8 3-0.2x 0.4
混合气体共3.4mol=0.8mol+(3-0.2x)mol+0.4mol,解得x=4,依据计算结果计算分析选项.
解答 解:A(g)+xB(g)?2C(g)
起始量(mol):1 3 0
转化量(mol):0.2 0.2x 0.4
平衡量(mol):0.8 3-0.2x 0.4
混合气体共3.4mol=0.8mol+(3-0.2x)mol+0.4mol,解得x=4,
A、平衡时,物质的量之比n(A):n(B):n(C)=0.8:2.2:0.4=4:11:2,故A错误;
B、根据计算可知x=4,故B错误;
C、A的转化率为$\frac{0.2}{1}$×100%=20%,故C正确;
D、B的平均反应速率为$\frac{0.8mol÷10L}{2min}$=0.04mol/(L•min),故D错误;
故选C.
点评 本题考查了化学平衡的计算应用,主要是平衡浓度,反应速率,反应物转化率的分析应用,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:填空题

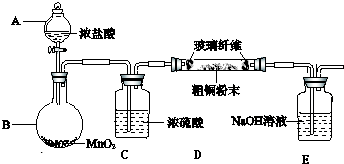
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n>p | B. | A 的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p2<p1 | B. | p1<p2<2p 1 | C. | p1>2p2 | D. | 2p1=p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性KMnO4溶液褪色,而苯和甲烷不能 | |
| B. | 苯酚能跟NaOH溶液反应而乙醇不能 | |
| C. | 乙烯能发生加成反应而乙烷不能 | |
| D. | 苯在50-60℃时发生硝化反应生成硝基苯,而甲苯在30℃时即可发生硝化反应生成三硝基甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6、-2 | +5、-3 | -2 | +3 |
| A. | 离子半径大小:R3+<X+<M2- | |
| B. | Y与M组成的化合物是光化学烟雾的原因之一 | |
| C. | 将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生 | |
| D. | R的单质是铝热剂的成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | 羟基的电子式: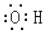 | ||
| C. | 苯酚的结构简式为C6H5OH | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
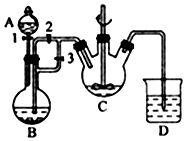 (1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为2BrO3-+10I-+12H+=5I2+Br2+6H2O.
(1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为2BrO3-+10I-+12H+=5I2+Br2+6H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com