
【题目】20℃,每100g水仅能溶解0.148gCa(OH)2。CaCO3在水中达到溶解平衡时,其Ksp为8.0×10-9(溶液密度近似为1g/cm3)。
(1)计算20℃时Ca(OH)2饱和溶液中的c(OH-);_________
(2)在10 mL Ca(OH)2饱和溶液中加入10mL0.10mol/L的K2CO3溶液,忽略溶液体积变化,通过计算判断是否生成CaCO3沉淀_________,并求此时溶液中c(Ca2+)。__________
【答案】0.04mol/L 有CaCO3沉淀生成 c(Ca2+)=2.0×10-7 mol/L
【解析】
(1)20℃,每100g水能溶解0.148gCa(OH)2,此时得到的Ca(OH)2溶液密度近似为1g/cm3,则Ca(OH)2的溶解度为s=0.148g/100g水,则水溶液中饱和溶液的物质的量浓度为c=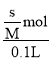 =
=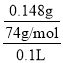 =0.02mol/L,因此Ca(OH)2的溶度积常数为Ksp[Ca(OH)2]=c(Ca2+)·c2(OH)= c ·(2c)2=4c3=3.2×105,则20℃时,Ca(OH)2饱和溶液中的c(OH)=0.04mol/L,
=0.02mol/L,因此Ca(OH)2的溶度积常数为Ksp[Ca(OH)2]=c(Ca2+)·c2(OH)= c ·(2c)2=4c3=3.2×105,则20℃时,Ca(OH)2饱和溶液中的c(OH)=0.04mol/L,
答案为:0.04mol/L;
(2)由(1)可知,Ca(OH)2饱和溶液中的c(OH)=0.04mol/L,则c(Ca2+)=![]() =0.02 mol/L,
=0.02 mol/L,
10mLCa(OH)2饱和溶液中n(Ca2+)=0.02 mol/L×0.01L=0.0002 mol,10mL0.1mol/LK2CO3中n(CO32)=0.1 mol/L×0.01L=0.001 mol,向10mLCa(OH)2饱和溶液中加入10mL0.1mol/LK2CO3溶液,混合后溶液体积为20ml,c(Ca2+)=![]() =0.01 mol/L,c(CO32)=
=0.01 mol/L,c(CO32)=![]() =0.05 mol/L,c(Ca2+)×c(CO32)=0.01 mol/L×0.05 mol/L=5×10-4>
=0.05 mol/L,c(Ca2+)×c(CO32)=0.01 mol/L×0.05 mol/L=5×10-4>![]() =8.0×10-9,则反应生成碳酸钙沉淀,根据反应 Ca2+(aq)+ CO32 (aq)CaCO3(s),0.0002 mol Ca2+消耗CO320.0002 mol,剩余n(CO32)=0.001 mol-0.0002 mol=0.0008mol,c(CO32)=
=8.0×10-9,则反应生成碳酸钙沉淀,根据反应 Ca2+(aq)+ CO32 (aq)CaCO3(s),0.0002 mol Ca2+消耗CO320.0002 mol,剩余n(CO32)=0.001 mol-0.0002 mol=0.0008mol,c(CO32)=![]() =0.04 mol/L,
=0.04 mol/L,
c(Ca2+)=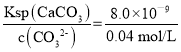 =2.0×10-7 mol/L,
=2.0×10-7 mol/L,
答案为:有CaCO3沉淀生成;c(Ca2+)=2.0×10-7 mol/L。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式不正确的是( )
A.用石墨电极电解饱和食盐水:2Cl- + 2H2O![]() 2OH-+ H2↑+ Cl2↑
2OH-+ H2↑+ Cl2↑
B.用Na2CO3溶液处理锅炉水垢中的CaSO4:CaSO4(s)+CO32-![]() CaCO3(s) + SO42-
CaCO3(s) + SO42-
C.过量铁粉与稀硝酸反应:Fe+NO3-+4H+= Fe3++NO↑+2H2O
D.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好沉淀完全:Ba2++OH-+H++SO42-= BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
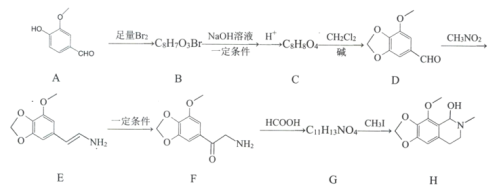
【题目】那可丁是一种药物,该药物适用于刺激性干咳病人服用,无成瘾性,化合物H是制备该药物的重要中间体,合成路线如下:
已知:①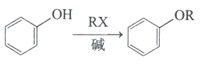
②RNH2 ![]() RNHCH3
RNHCH3
(1)化合物B的结构简式:________
(2)反应B→C的第一步反应类型:____________
(3)下列说法正确的是:___________。
A.物质D能与FeCl3发生显色反应 B.物质F具有碱性
C.物质G能和银氨溶液发生反应 D.物质H的分子式是C12H15NO4
(4)写出C→D的化学方程式:____________________________
(5)请写出化合物H满足下列条件的所有同分异构体的结枸简式:_______________
①分子中含苯环,无其他环状结构
②分子中含有-NO2且直接连在苯环上
③分子中只有3种不同化学环境的氢
(6)已知![]() ,请以
,请以![]() 、CH3CHClCH3为原料合成化合物
、CH3CHClCH3为原料合成化合物![]() ,写出制备的合成路线流程图(无机试剂任选)__________________________
,写出制备的合成路线流程图(无机试剂任选)__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是

A. 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3反应速率相等
C. 图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CrO42-和Cr2O72-在溶液中可相互转化。室温下,1.0×10-3mol/L的Na2CrO4溶液中c(Cr2O72-)随pH的变化如图所示。

(1)用离子方程式表示Na2CrO4溶液中的可逆反应________________。
(2)调节该溶液的酸碱性使pH减小,观察到实验现象为_______________根据图示中A点数据,计算出该转化反应的平衡常数________;
(3)温度升高,溶液中CrO42-的平衡转化率减小,则该反应的ΔH____0(填“大于”、“等于”或“小于”)。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定待测液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,作为滴定终点标志。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为____ mol/L,此时溶液中c(CrO42-)等于____ mol/L。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,盐桥中装有含琼胶的KCl饱和溶液。下列有关叙述中正确的是( )
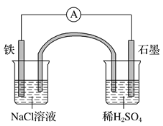
A.Fe作正极,发生氧化反应B.工作一段时间后,两烧杯中溶液pH均不变
C.负极反应:2H++2e-=H2↑D.工作一段时间后,NaCl溶液中c(Cl-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某物质X能发生如下转化:
![]()
下列有关上述转化关系中物质及其反应的叙述错误的是( )
A.若X为![]() 或
或![]() ,则A为硝酸
,则A为硝酸
B.若X为![]() 或
或![]() ,则A为硫酸
,则A为硫酸
C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往锅炉注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸去除,下列叙述正确的是
A. 温度升高Na2CO3溶液的Kw和c(H+)均会增大
B. CaSO4能转化为CaCO3,说明Ksp(CaCO3)>Ksp(CaSO4)
C. CaCO3溶解于盐酸而CaSO4不溶,是因为硫酸酸性强于盐酸
D. 沉淀转化的离子方程式为CO32(aq)+CaSO4(s)![]() CaCO3(s)+SO42(aq)
CaCO3(s)+SO42(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯的下列叙述:①能使酸性KMnO4溶液褪色②可发生加聚反应③可溶于水④可溶于苯中⑤苯环能与溴水发生取代反应⑥所有的原子可能共面。其中完全正确的是( )
A.①②④⑥
B.①②④⑤⑥
C.①②③④
D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com