

| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 Al(OH)3 | 2.7 3.7 | 3.7 4.7 |
 .
.分析 硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质,加入硫酸,MgO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,滤渣1为SiO2,过氧化氢具有氧化性,加入的过氧化氢可把亚铁离子氧化成铁离子,加入氢氧化钠,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子和氢氧根离子形成氢氧化铝沉淀,过滤滤渣2为Fe(OH)3、Al(OH)3,滤液中含镁离子,调节PH=12,得到滤渣3Mg(OH)2,洗涤烘干得到Mg(OH)2晶体.
(1)MgO为离子化合物,其电子式由阴离子氧离子、阳离子镁离子的电子式组合而成,据此书写;
(2)PH=6,滤渣2的主要成分是Fe(OH)3、Al(OH)3,氢氧化铝具有两性,向滤渣2中继续加入过量的NaOH溶液,氢氧化铝溶解;
(3)加入NaOH调节溶液pH=12.0时,镁离子和氢氧根离子反应生成氢氧化镁;
(4)根据Mg(OH)2与含SO2的烟气反应生成MgSO4,反应物必有O2,据此书写;
(5)根据镁元素守恒计算.
解答 解:硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质,加入硫酸,MgO、Fe2O3、FeO、Al2O3都和硫酸反应,MgO+H2SO4═MgSO4+H2O,Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,FeO+H2SO4═FeSO4+H2O、Al2O3+3H2SO4═Al2(SO4)3+3H2O,SiO2不与硫酸反应,滤渣1为SiO2,
过氧化氢具有氧化性,加入的过氧化氢可把亚铁离子氧化成铁离子,H2O2+2Fe2++2H+═2Fe3++2H2O;
加入氢氧化钠,溶液pH升高,调PH=6.0,铁离子生成氢氧化铁沉淀,Fe3++3OH-═Fe(OH)3↓;
铝离子和氢氧根离子形成氢氧化铝沉淀,Al3++3OH-═Al(OH)3↓;过滤滤渣2为Fe(OH)3、Al(OH)3,
滤液中含镁离子,调节PH=12,Mg2++2OH-═Mg(OH)2↓;得到滤渣3:Mg(OH)2,洗涤烘干得到Mg(OH)2晶体.
(1)MgO是离子化合物,由Mg2+离子和O2-离子构成,MgO的电子式 ,故答案为:
,故答案为: ;
;
(2)加入氢氧化钠,溶液pH升高,调PH=6.0,铁离子生成氢氧化铁沉淀,Fe3++3OH-═Fe(OH)3↓;铝离子和氢氧根离子形成氢氧化铝沉淀,Al3++3OH-═Al(OH)3↓;过滤滤渣2为Fe(OH)3、Al(OH)3,氢氧化铝具有两性,向滤渣2中继续加入过量的NaOH溶液,发生反应Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Fe(OH)3、Al(OH)3;Al(OH)3+OH-═AlO2-+2H2O;
(3)滤液中含镁离子,调节PH=12,Mg2++2OH-═Mg(OH)2↓,故答案为:Mg2++2OH-═Mg(OH)2↓;
(4)氢氧化镁无氧化性,根据信息反应物为Mg(OH)2、SO2、产物为MgSO4,所以反应物必有O2,所以该反应为:2Mg(OH)2+2SO2+O2═2MgSO4+2H2O,
故答案为:2Mg(OH)2+2SO2+O2═2MgSO4+2H2O;
(5)设硼泥中MgO的质量分数为x,根据镁原子守恒:$\frac{b×1{0}^{6}g}{58g/mol}=\frac{a×1{0}^{6}g×x}{40g/mol}$,解得x=$\frac{20b}{29a}$,故答案为:$\frac{20b}{29a}$.
点评 本题考查了从硼泥生产氢氧化镁的方法,涉及了电子式、镁、铝、铁及其化合物的性质、氢氧化镁晶体的产率计算等知识,注意沉淀的成分与PH值之间的关系,题目难度中等.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
 分子中饱和碳原子数为a,可能在同一直线上的碳原子数为b,可能在同一平面上的碳原子数最多为c,则a、b、c分别为( )
分子中饱和碳原子数为a,可能在同一直线上的碳原子数为b,可能在同一平面上的碳原子数最多为c,则a、b、c分别为( )| A. | 4、3、7 | B. | 4、3、8 | C. | 2、5、4 | D. | 4、6、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
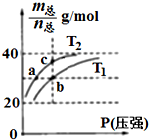 已知(HF)2(g)?2HF(g),△H>0,且平衡体系的总质量[m(总)]与总物质的量[n(总)]之比在不同温度下随压强的变化曲线如图所示.下列说法正确的是( )
已知(HF)2(g)?2HF(g),△H>0,且平衡体系的总质量[m(总)]与总物质的量[n(总)]之比在不同温度下随压强的变化曲线如图所示.下列说法正确的是( )| A. | 温度:T1<T2 | |
| B. | 平衡常数:K(a)=K(b)<K(c) | |
| C. | 反应速率:Vb>Va | |
| D. | 当$\frac{m(总)}{n(总)}$=30g/mol时,n(HF):n(HF)2=2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 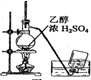 制备乙烯 | B. | 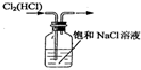 除去Cl2中的HCl | ||
| C. | 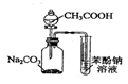 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 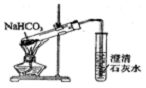 探究NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其中含氧官能团名称是羟基.
,其中含氧官能团名称是羟基.
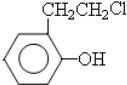 ,
,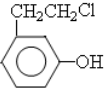 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| CO | H2O | CO2 | H2 | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |
| A. | 容器①中反应达平衡时,CO的转化率为80% | |
| B. | 容器①中CO的转化率等于容器②中CO2的转化率 | |
| C. | 容器①中CO反应速率等于H2O的反应速率 | |
| D. | 平衡时,两容器中CO2的浓度相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com