


| 0.672L |
| 22.4L/mol |
| 2.7g |
| 27g/mol |
| 3 |
| 2 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯原子的结构示意图: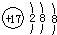 | ||
B、作为相对原子质量测定标准的碳核素:
| ||
C、氯化镁的电子式: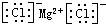 | ||
| D、乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压 强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体 总浓度/ mol?L-1 | 2.4× 10-3 | 3.4× 10-3 | 4.8× 10-3 | 6.8× 10-3 | 9.4× 10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
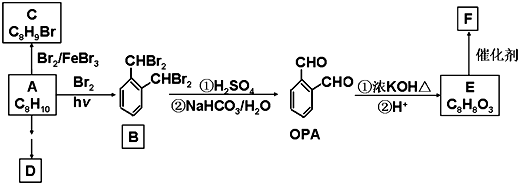

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 加热 |
| 氯化钙溶液 |
| 硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、美丽的“水立方”是北京奥运会游泳馆,设计灵感来自于有机细胞的天然图案以及肥皂泡的形成.在这个中心的蓝色泡墙之内,钢结构的基本单位是一个由12个正五边形和2个正六边形组成的几何细胞,覆盖这个框架的是半透明的“气泡”,称为ETFE,该材料为四氟乙烯(CF2=CF2)与乙烯的共聚物,ETFE属于有机物中的烃类. |
| B、5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂,如:Ca(ClO)2、ClO2、Al(OH)3等. |
| C、美国科学家马丁?查非(Martin Chalfie)、美国华裔化学家钱永健(Roger Tsien)以及日本科学家下村修(Osamu Shimomura)因发现和研究绿色荧光蛋白(green fluorescent protein,GFP)而获2008年度诺贝尔化学奖.向GFP中加入重金属离子,GFP就会变性. |
| D、神舟七号载人飞船于2008年9月25日21点10分发射升空.中国航天员首次空间出舱活动.“神舟七号”的燃料是氢化锂三兄弟--LiH、LiD、LiT.其中Li的质量数为7,这三种物质的化学性质不相同. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com