
(14分)钨是我国丰产元素,也是熔点最高的金属,被誉为“光明使者”。用黑钨矿[FeWO4、MnWO4(W为+6价)]结合其它化工生产高纯钨的化工流程如下。已知H2WO4是不溶于水的弱酸,受热可分解生成氧化物。请回答下列有关问题:
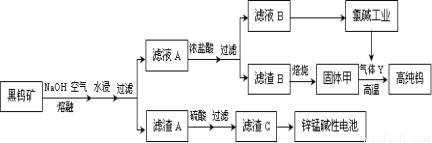
(1)上述流程中通入空气的目的是 ;
(2)滤渣A与硫酸反应的离子方程式为 ;
(3)实验室用锌锰碱性电池作做电源模拟氯碱工业的装置如下图:
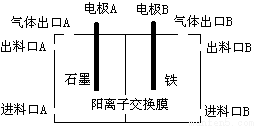
已知:锌锰碱性电池的总反应为Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,则锌锰碱性电池的锌电极应与装置中电极 (填“A”或“B”)相接,气体Y为气体出口 (填“A”或“B”)出来的气体,为提高生产效率,电解开始时,从进料口B加入的物质为 ,写出锌锰碱性电池正极反应式 ;
(4)已知:单质碳也可与固体甲制得钨,用气体Y而不用单质碳的原因 ;
(5)将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(1) ΔH2=-285.8 kJ/mol
H2O(1) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
(14分)
⑴ 氧化Fe2+、Mn2+(2分)
⑵ Fe2O3 + 6H+ = 2Fe3+ + 3H2O 或 Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O(2分)
⑶ B(1分) B(1分)
稀氢氧化钠溶液(1分) MnO2 + e- + H2O = MnOOH + OH-(2分)
⑷会引入杂质碳;会生成碳化钨(2分,任答一点)
⑸CO2(g)+4H2(g)=CH4(g)+2H2O(l)ΔH=-252.9kJ/mol(3分)
【解析】
试题分析:(1)因为锌锰碱性电池中含有二氧化锰,所以通入空气的目的是氧化Fe2+、Mn2+,使其转化为Fe3+、Mn4+;
(2)因为亚铁离子被氧化为铁离子,与氢氧化钠反应生成氢氧化铁沉淀,在加热条件下,最终转化为氧化铁或四氧化三铁,所以滤渣A与稀硫酸反应实质是氧化铁与稀硫酸反应,离子方程式是Fe2O3 + 6H+ = 2Fe3+ + 3H2O 或 Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O;
(3)碱性锌锰电池的Zn发生氧化反应,作原电池的负极,滤液A与盐酸反应生成钨酸沉淀,焙烧分解生成WO3,氯碱工业中产生的气体有氢气和氯气,而氢气可还原WO3为W,氢气在负极产生,而Fe不能做阳极,所以Fe极为阴极,所以锌锰碱性电池的锌电极应与装置中电极B相连,则氢气在B口出来的气体;为增强溶液的导电性,在进料口B处加入稀NaOH溶液;碱性锌锰电池的正极发生还原反应,二氧化锰得到电子生成MnOOH,电极反应式为MnO2 + e- + H2O = MnOOH + OH-;
(4)若用碳单质还原WO3,则W中可能含有C单质,而用氢气还原,则不会产生杂质;
(5)利用盖斯定律将氧气消去,所以CO2(g)与H2(g)反应生成CH4(g)与液态水的反应热ΔH=4ΔH2-ΔH1=-252.9kJ/mol,所以CO2(g)与H2(g)反应生成CH4(g)与液态水的的热化学方程式是CO2(g)+4H2(g)=CH4(g)+2H2O(l)ΔH=-252.9kJ/mol。
考点:考查工业流程的分析,电化学反应原理的应用,盖斯定律的应用
考点分析: 考点1:化学反应与能量 考点2:离子方程式 考点3:电解池 试题属性

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源:2014-2015江西省新余市高一上学期期末考试化学试卷(解析版) 题型:推断题
已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。

(1)写出A、C、F、G的化学式:A ,C ,F ,G 。
(2)检验D中阳离子的方法 。
(3)保存C溶液时为什么要加固体A 。
(4)写出下列转化的离子方程式C→D: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省新余市高一上学期期末考试化学试卷(解析版) 题型:选择题
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
A.2010年11月广州亚运会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
C.小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
D.青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省六校高三3月联考理综化学试卷(解析版) 题型:选择题
将反应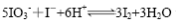 设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是
设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是
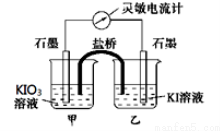
A.开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应
B.开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝
C.电流计读数为零时,反应达到化学平衡状态
D.两次电流计指针偏转方向相反
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省遂宁市高三第二次诊断考试化学试卷(解析版) 题型:选择题
常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
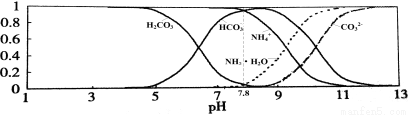
A.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小
C.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三3月模拟考试理综化学试卷(解析版) 题型:实验题
(19分)某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验。
I.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2。
(1)甲同学设计如图装置进行实验:
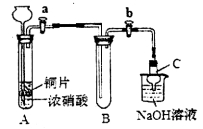
①试管A中反应的离子方程式是___________。
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为__________。
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是________________。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设正确。则NO2和Na2O2反应的化学方程式是_______________。
II.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2==2NaNO2;2NaNO2+2HCl==2NaCl+NO2↑+NO↑+H2O:酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
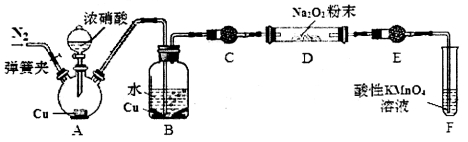
①在反应前,打开弹簧夹,通入一段时间N2,目的是____________________。
②B中观察到的主要现象的是_________(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是______(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为_________________。
⑤充分反应后,检验D装置中产物的方法是:取D装置中产物少许,__________________,则产物是NaNO2。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期。下列说法错误的是
A.原子半径:Z>R>W
B.气态氢化物稳定性:HmW>HnR
C.Y、Z、R三种元素组成的化合物水溶液一定显碱性
D.X2W6分子中各原子均满足8电子结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com