
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中,每生成1 mol AlN需转移3 mol电子 | |
| C. | AlN中氮元素的化合价为+3价 | |
| D. | AlN的摩尔质量为41 g |
分析 A.在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
B.根据AlN和转移电子之间的关系式计算;
C.在化合物中电负性大的显负价,电负性小的显正价;
D.摩尔质量的单位是g/mol.
解答 解:A.该反应中,氧化剂氮气,还原剂是碳,故A错误;
B.反应中N元素的化合价从0价降低到-3价,转移3个电子,则每生成1molAlN需转移3mol电子,故B正确;
C.氮化铝中氮元素的化合价是-3价,故C错误;
D.氮化铝的摩尔质量是41g/mol,故D错误;
故选B.
点评 本题考查氧化还原反应,明确元素化合价即可分析解答本题,题目难度不大,侧重于基础知识的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 大理石和稀盐酸反应CO32-+2 H+═CO2↑+H2O | |
| B. | 铜和稀硝酸反应3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| C. | 氢氧化钡溶液加入稀硫酸中:OH-+H+═H2O | |
| D. | 铝和烧碱溶液反应 A1+2OH-═A1O2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
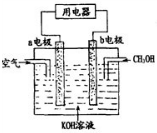 (1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.
(1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下
二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下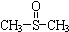 生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,有关反应如下:
生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,有关反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,用浓度为0.1000mol•L-1 的NaOH溶液滴定20mL 浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 的NaOH溶液滴定20mL 浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX | |
| B. | 根据滴定曲线,可得Ka(HY)≈10-6 | |
| C. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | HY与HZ混合,达到平衡时:c(H+)═c(Y-)+c(Z-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明溶液中:K+、Cu2+、SO42-、Na+ | |
| B. | pH=12的溶液中:K+、Na+、SO42-、CH3COO-、CO32- | |
| C. | 加入铝片能放出H2的溶液中:Na+、HCO3-、Cu2+、SO42- | |
| D. | 由水电离出的c(H+)=1×10-12 mol/L的溶液中:NH4+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
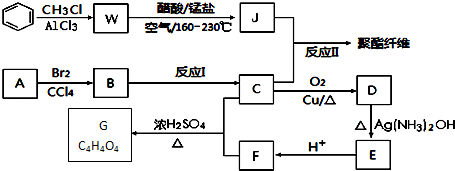
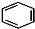 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$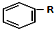 +HCl(-R为烃基)
+HCl(-R为烃基)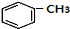 $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$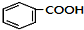
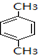 .
. .
.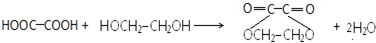 .
.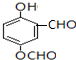 (写出一种即可);
(写出一种即可);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中共价键越强,熔沸点越高 | |
| B. | 只含共价键的物质,一定是共价化合物 | |
| C. | HF的分子间作用力大于HCl,故HF比HCl更稳定 | |
| D. | 分子晶体中,可能不存在共价键,但一定存在分子间作用力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com