
对于可逆反应:2A(g)+B(g)⇌2C(g);△H<0,下列各图正确的是(设变化过程中物质的聚集状态没有发生改变)( )
|
| A. |
| B. |
| C. |
| D. |
|
考点:
体积百分含量随温度、压强变化曲线;化学平衡的影响因素;转化率随温度、压强的变化曲线;化学反应速率与化学平衡图象的综合应用.
专题:
化学平衡专题.
分析:
做题时首先分析化学方程式的特征,如反应前后计量数的大小关系、反应热等问题,本题中:
A、根据反应温度的不同结合反应热判断平衡移动的方向,可判断出C的质量分数的变化是否正确;
B、根据反应前后的化学计量数的大小关系,结合压强对反应速率的影响判断平衡移动方向,从而判断出正逆反应速率的变化;
C、从催化剂对平衡是否有影响来判断浓度的变化是否正确;
D、从两个方面考虑,一是压强对平衡的影响,二是温度对平衡的影响,二者结合判断A的转化率是否正确.
解答:
解:A、该反应为放热反应,温度升高平衡向逆反应方向移动,C的质量分数减小,故A正确;
B、根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,故B错误;
C、催化剂同等程度地改变正逆反应速率,平衡不发生移动,故C错误;
D、该反应为放热反应,温度升高平衡向逆反应方向移动,A的转化率降低,根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,故D错误.
故选A.
点评:
本题为化学平衡图象题,做题时注意两个方面的问题:(1)定一议二:当图象中同时有三个变量时,使其中之一不变,讨论另外两个变量间的关系;(2)先拐先平:变化曲线若与时间轴平行,表示反应体系已达平衡状态,先达到平衡(先出现拐点)的曲线所示的温度或压强较大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、SO42﹣
②pH=11的溶液中:CO32﹣、AlO2﹣、NO3﹣、Na+
③加入Al能放出H2的溶液中:Cl﹣、SO42﹣、NO3﹣、NH4+
④由水电离出的c(OH﹣)=10﹣13mol•L﹣1的溶液中:Na+、Ba2+、Cl﹣、I﹣
⑤使pH试纸变为红色的溶液:Na+、Cl﹣、S2﹣、ClO﹣
⑥无色溶液中:K+、Al3+、NO3﹣、HCO3﹣.
|
| A. | ①②⑤ | B. | ③⑤⑥ | C. | ②④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
Zn﹣MnO2干电池应用广泛,其电解质溶液是ZnCl2﹣NH4Cl混合溶液.
(1)该电池的负极材料是 .负极的电极反应为
(2)若ZnCl2﹣NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 .欲除去Cu2+,最好选用下列试剂中的 (填代号).
a.NaOH b.Zn c.Fe d.NH3•H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:
在不同情况下测得A(g)+3B(g)⇌2C(g)+2D(g)的下列反应速率,其中反应速率最大的是( )
|
| A. | υ(D)=0.4 mol•L﹣1•s﹣1 | B. | υ(C)=0.5 mol•L﹣1•s﹣1 |
|
| C. | υ(B)=0.6 mol•L﹣1•s﹣1 | D. | υ(A)=2 mol•L﹣1•min﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组试剂(括号内的是滴加试剂)做溶液导电性实验的过程中,可以观察到灯泡由亮变暗直至熄灭,然后又逐渐变亮的是( )
|
| A. | BaCl2溶液(稀硫酸) | B. | 氨水(醋酸溶液) |
|
| C. | Ba(OH)2溶液[Ba(HCO3)2溶液] | D. | Ba(OH)2溶液(NaHSO4溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:
在100℃和200kPa的条件下,反应aA(g)⇌bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步压缩体系的体积,增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
| 压强(kPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
根据表中的数据,回答下列问题:
(1)压强从200kPa增加到500kPa时,平衡 移动(填“正向”或“逆向”或“不”),理由是 .
(2)压强从500kPa增加到1000kPa时,平衡 移动(填“正向”或“逆向”或“不”),其原因可能为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是:()
选项 A B C D
X C Fe Ca(OH)2溶液 AlCl3
W O2 HNO3 CO2 NH3•H2O
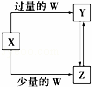
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如下图所示。
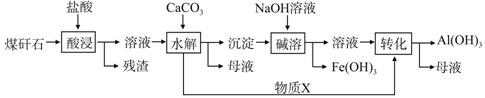
(1)写出“酸浸”过程中主要反应的离子方程式(任写一个):
。
(2)物质X的化学式为________。“碱溶”时反应的离子方程式为__________________。
(3)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得Al(OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过程是 ,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3
(4)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3饱和溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体。结合化学平衡移动原理解释析出晶体的原因:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com