
【题目】常温下,用0.100mol·L-1NaOH溶液滴定10mL0.100mol·L-1H3PO4溶液,曲线如图所示。下列说法正确的是
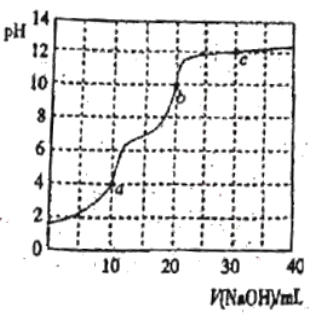
A.滴定终点a可选择酚酞作指示剂
B.c点溶液中c(Na+)>3c(![]() )+2c(
)+2c(![]() )+c(
)+c(![]() )
)
C.b点溶液中c(![]() )>c(
)>c(![]() )>c(
)>c(![]() )
)
D.a、b、c三点中水的电离程度最小的是c
【答案】B
【解析】
A. 滴定终点a溶液呈酸性,酚酞变色的pH范围为8~10,不能选择酚酞作指示剂,可选择甲基橙作指示剂,故A错误;
B. c点溶液呈碱性,根据电荷守,c(H+)+c(Na+)=3c(![]() )+2c(
)+2c(![]() )+c(
)+c(![]() )+c(H+),所以 c(Na+)>3c(
)+c(H+),所以 c(Na+)>3c(![]() )+2c(
)+2c(![]() )+c(
)+c(![]() ),故B正确;
),故B正确;
C. b点向10mL0.100mol·L-1H3PO4溶液中滴入20mL0.100mol·L-1NaOH溶液,溶液中溶质为Na2HPO4,溶液呈碱性,![]() 水解大于电离,溶液中c(
水解大于电离,溶液中c(![]() )>c(
)>c(![]() )>c(
)>c(![]() ),故C错误;
),故C错误;
D. a点溶质为NaH2PO4、b点溶质为Na2HPO4、c点溶质为Na3PO4,三点中水的电离程度最大的是c,故D错误;
选B。


科目:高中化学 来源: 题型:
【题目】对溴苯乙烯与丙烯的共聚物E是一种高分子阻燃剂,具有低毒、热稳定性好等优点.由烃A合成E的路线如图所示.
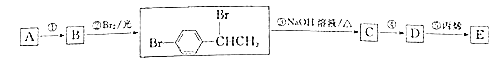
回答下列问题:
(1)![]() 的名称 ______ ;
的名称 ______ ;![]() 的反应条件 ______ .
的反应条件 ______ .
(2)共聚物E的结构简式 ______ .
(3)反应![]() 的化学方程式 ______
的化学方程式 ______ ![]() 反应
反应![]() 的化学方程式 ______ .
的化学方程式 ______ .
(4)满足下列条件的C的同分异构体的结构简式 ______ ![]() 任写一种
任写一种![]() .
.
![]() 能使
能使![]() 溶液呈紫色
溶液呈紫色 ![]() 核磁共振氢谱显示有3组峰面积比为6:2:1.
核磁共振氢谱显示有3组峰面积比为6:2:1.
(5)丙烯催化二聚得到2,![]() 二甲基
二甲基![]() 丁烯,F与2,
丁烯,F与2,![]() 二甲基
二甲基![]() 丁烯互为同分异构体,且所有碳原子处于同一平面,写出F的结构简式 ______ .
丁烯互为同分异构体,且所有碳原子处于同一平面,写出F的结构简式 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。
N2+3H2![]() 2NH3
2NH3
现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是_______。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有_______。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
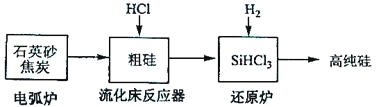
发生的主要反应 | |
电弧炉 | SiO2+2C |
流化床反应器 | Si+3HCl |
还原炉 | SiHCl3+H2 |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为_______;碳化硅又称_______,其晶体结构与_______相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的产物为_______。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸(H2C2O4)是一种二元弱酸,草酸及其盐广泛用于医药、印染、塑料等工业。
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
电离常数(mol·L-1) | K1=5.6×10-2 K2=5.4×10-3 | K1=1.7×10-5 | K2=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
①25℃时,浓度均为0.1mol·L-1的Na2C2O4、CH3COONa、NaCN、Na2CO3的pH由大到小的顺序是___。中和等体积、等pH的HCOOH和HCN消耗NaOH的量___(填“前者大”“后者大”或“相等”)。
②下列关于0.1mol·L-1NaHC2O4溶液的说法正确的是___。
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示。又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是____

A.在t℃时,MgC2O4的Ksp=8.1×10-5mol2·L-2
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4(s)+2OH-(aq)Mg(OH)2(s)+C2O42-(aq)平衡常数K=![]()
(3)草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解。某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
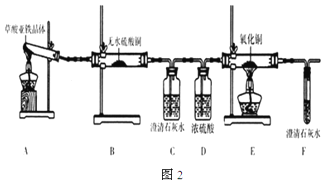
①从环保角度考虑,该套实验装置的明显缺陷是___。
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃___(填“A”或“E”)处的酒精灯。
③若实验过程中观察到B中白色无水CuSO4变成蓝色,___(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4·2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g。若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为___。草酸亚铁晶体分解的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(HOOC-COOH)俗称草酸。草酸晶体的化学式为H2C2O4·2H2O,草酸在100℃时开始升华,157℃时大量升华,并开始分解产生CO、CO2和H2O,草酸蒸气在低温下可冷凝为固体;草酸是一种二元弱酸但酸性比碳酸强,具有还原性能使酸性高锰酸钾溶液褪色,草酸钙难溶于水,回答下列问题:
(1)写出草酸晶体受热分解的化学方程式___。
(2)可用下列装罝验证草酸晶体的分解产物(草酸晶体分解装置、夹待装置及连接导管均略去)。

①装置的连接顺序为:___、___DEDE___、___。
②A装置的作用是___,检验产物中有CO的实验现象是___。
③写出整套装置存在不合理之处___。
(3)下列叙述能说明草酸具有弱酸性的是___。
a.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
b.测定草酸钠(Na2C2O4)溶液的pH
c.等体积等浓度的草酸溶液和稀硫酸,稀硫酸消耗碱的能力强
d.pH=2的草酸溶液和稀硫酸,分别稀释100倍后前者pH小
e.将草酸晶体加入Na2CO3溶液中,有CO2放出
(4)已知:NH3·H2ONH4++OH-,Kb=1.85×10-5
H2C2O4H++HC2O4-,Ka1=5.4×10-2
HC2O4-H++C2O42-,Ka2=5.4×10-5
则(NH4)2C2O4溶液的pH___7(填“>”或“<”或“=”)。
(5)可用0.10mol/L酸性KMnO4标准溶液来滴定未知浓度的草酸溶液。
①确定过程中发生反成的离子方程式为___;
②滴定过程中操作滴定管的图示正确的是___。
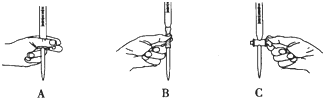
③每次准确量取25.00mL草酸溶液,滴定三次分别消耗0.10mol/L酸性KMnO4标准溶液的体积是20.00mL、19.80mL、20.20mL,则该草酸溶液的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置制备Cl2并检验其性质,下列说法正确的是( )
A.I图中:如果MnO2过量,浓盐酸就可全部消耗完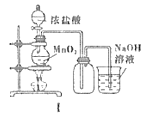
B.II图中:用排饱和食盐水收集一试管氯气,充分光照后,水槽中溶液酸性增强,量筒中液面上升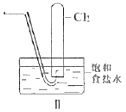
C.III图中:生成蓝色的烟,若向集气瓶中加入少量水,所得溶液呈黄色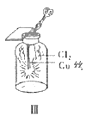
D.IV图中:干燥的有色布条不褪色,湿润的有色布条能褪色,说明Cl2有漂白性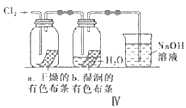
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
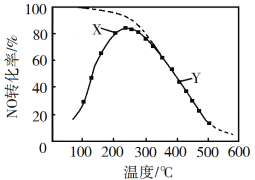
A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com