
 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4.
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4.分析 (1)根据MnO2+SO2=MnSO4可知n(SO2)=n(MnO2)来解答;
(2)从MnSO4和MgSO4混合溶液中结晶MnSO4•H2O晶体,根据图上信息,高于60℃以后MnSO4•H2O的溶解度减小,而MgSO4•6H2O的溶解度增大.
解答 解:(1)根据MnO2+SO2=MnSO4可知,n(SO2)=n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol,其体积为0.2mol×22.4L/mol=4.48L,
故答案为:4.48;
(2)从MnSO4和MgSO4混合溶液中结晶MnSO4•H2O晶体,根据图上信息,高于60℃以后MnSO4•H2O的溶解度减小,而MgSO4•6H2O的溶解度增大,因此控制结晶温度范围是高于60℃这样可以得到纯净的MnSO4•H2O;
故答案为:60℃.
点评 本题考查氧化还原反应计算、图象分析等,侧重分析、计算能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应过程 | 化学方程式 | 焓变△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液 | B. | 硝酸银溶液 | C. | 碳酸钡粉末 | D. | 生石灰粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
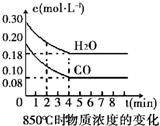 在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如右图,t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如右图,t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.48L | B. | 5.6L | C. | 6.72L | D. | 7.84L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com