
����Ŀ��ˮ����(N2H4��H2O)����ɫ����ǿ��ԭ�Ե�Һ�壬ʵ�����Ƹ�ˮ���µ�ԭ��Ϊ��CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4��H2O+NaCl �ݴˣ�ijѧ�����������ʵ�顣
����1���Ʊ�NaC1O��Һ����֪��3NaC1O![]() NaC1+NaC1O3
NaC1+NaC1O3

(1)���ռ��������30��NaOH��Һʱ�����貣����������Ͳ���_______(����ĸ)��
A������ƿ B���ձ� C����Һ�� D��������
(2)װ��A�з�����Ӧ�����ӷ���ʽ��__________����װ��C�г��ֶ�����������a�е�����Ϊ_______________��B���ñ�ˮԡ�����¶���30�����£�����ҪĿ����______________��
����2����ȡˮ���¡�
���Ʒ�Ӧ�¶ȣ�����Һ©���е���Һ��������������ƿ�У���ַ�Ӧ����������������ƿ�ڵ���Һ���ռ�108~114����֡�(��֪��N2H4��H2O+2NaC1O=N2��+3H2O+2NaC1)��
(3)��Һ©���е���Һ��___________(����A������B��)��
A��NaOH��NaC1O�����Һ B��CO(NH2)2��Һ

����3���µ����ʷ�����ⶨ��
(4)ˮ�����백ˮ�������ƣ����ڶ�Ԫ���ˮ���������ᷴӦ���������λ�ѧʽΪ_______________��
(5)ˮ���¾��л�ԭ�ԣ����������ɵ�������ȡ���0.3000g����ˮ��ɼ�20.00mL��Һ��һ����������0.1500 mol/L��I2��Һ�ζ���
��ˮ���������Һ��Ӧ�Ļ�ѧ����ʽΪ_______________________________________��
��ʵ��������I2��Һ��ƽ��ֵΪ20.00mL�������N2H4��H2O����������Ϊ__________��(������λ��Ч����)
���𰸡�BD MnO2+4H++2Cl-=Mn2++Cl2��+2H2O Һ������ ��ֹNaClO�ֽ�ΪNaCl��NaClO3��Ӱ��ˮ���µIJ��� A N2H6Cl2 N2H4��H2O��2I2��N2����4HI��H2O 25.0%
��������
װ��A������������Ũ���ᷴӦ��ȡ��������ȡ�������к����Ȼ��⣬װ��B�в�����a������Ϊƽ��ѹǿ���������������Ʒ�Ӧ�Ʊ�NaClO�������ñ�ˮԡ�����¶���30�����£���ֹNaClO(�绯)�ֽ�Ϊ�����ƺ��Ȼ��ƣ�װ��C����β��������
(1)��������һ��������������Һ�IJ���ѡ��������
(2)B���������������Ʒ�Ӧ�Ʊ�NaClO��B�в�����a������ƽ��ѹǿ����ȡ�������к����Ȼ��⣬Ϊ�����NaClO�IJ��ʣ����A�в�����Cl2���о���������֪��Ϣ��֪���ڷ�Ӧ����������Ӧ��B���ñ�ˮԡ�����¶���30�����£���������Ŀ���Ǽ��ٸ���Ӧ�ķ��������ˮ���µIJ��ʣ�
(3) N2H4H2O����ǿ��ԭ�ԣ����ױ�������NaClO����ȷ������A���Լ���
(4)ģ��NH3��HCl��Ӧ����������дˮ������HCl��Ӧ�������εĻ�ѧʽ��
(5) �����õ����غ㡢ԭ���غ������⣬д����Ӧ�Ļ�ѧ����ʽ��
�ڸ��ݢٷ���ʽ���м��㡣
(1)����30%NaOH��Һʱ������ƽ�������������ձ��м�ˮ�ܽ⣬���ò��������裬��Ҫ���������У��ձ���������������ѡ��ΪBD��
(2)װ��A��Ũ������MnO2��ϼ�����ȡ������������Ӧ�����ӷ���ʽ��MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O����C�з�������ʱ��B������ѹǿ����B��Һ����볤�������У�ʹ����������Һ���������γ�ˮ�������¶�����ʱ����������������������������ԭ��Ӧ���������ƺ��Ȼ��ƣ��������ʲ��������Ա�ˮԡ�¶���Ҫ��30�����£�����ҪĿ���Ƿ�ֹNaClO(�绯)�ֽ�Ϊ�����ƺ��Ȼ��ƣ�Ӱ��ˮ���µIJ��ʣ�
Mn2++Cl2��+2H2O����C�з�������ʱ��B������ѹǿ����B��Һ����볤�������У�ʹ����������Һ���������γ�ˮ�������¶�����ʱ����������������������������ԭ��Ӧ���������ƺ��Ȼ��ƣ��������ʲ��������Ա�ˮԡ�¶���Ҫ��30�����£�����ҪĿ���Ƿ�ֹNaClO(�绯)�ֽ�Ϊ�����ƺ��Ȼ��ƣ�Ӱ��ˮ���µIJ��ʣ�
(3)��������ƿ������Ӧ��CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4��H2O+NaCl ��N2H4H2O����ǿ��ԭ�ԣ����ױ�������NaClO���������Է�Һ©����ʢ��NaOH+NaC1O��
(4)ˮ�������ڶ�Ԫ���ˮ�����������������ΪN2H6Cl2��
(5)��ˮ���¾��л�ԭ�ԣ��䱻I2�����ķ���ʽΪN2H4��H2O��2I2��N2����4HI��H2O
���������ˮ����(N2H4H2O)����������Ϊa������ݷ�Ӧ����ʽ��
N2H4H2O + 2I2 = N2�� + 4HI + H2O
50g 2mol
0.3000g��a 0.020L��0.15mol/L
50g��0.3000g��a=2mol��0.020L��0.15mol/L����ã�a=25%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Լ������˵���У�����ȷ���ǣ� ��
A.������ˮ��������ɫ�Լ�ƿ��
B.����Na������ú����
C.Ư�۱����ڳ���������
D.��������Ӧ�ܷⱣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����գ��й���ѧ���з���һ��̼���ε�����������ʵ����ľ����ѡ�������õ���������ش��������⣺
��1����̬̼ԭ�ӵĺ��������____���˶�״̬�� ��̬Niԭ�ӵĺ�������Ų�ʽΪ_________________��
��2��C��N��O����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ______________________��
��3��ͼ1��ʾ��������̼ԭ�ӵ��ӻ���ʽΪ_________�����ڵĻ�ѧ��������_________(����)��

A.���ۼ� B.���Ӽ� C.��λ�� D.������ E.���
��4��̼��������CO����Ϊ����������������壬CO��N2��Ϊ�ȵ����壬��CO�����ЦҼ���м��ĸ�����Ϊ______������۵�Ϊ170�棬Ԥ������___________���塣
��5��һ�ִ������������ þԪ����ɣ��侧���ṹ��ͼ2��ʾ����þ���Ļ�ѧʽΪ__________���侧���߳�Ϊapm����ʽ���㾧���ܶ�Ϊ___________g/cm3 (���ؼ��������������ӵ��곣����ֵΪNA)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϣ�����ұǦ����(����Pb��PbO��PbS��PbCO3��Pb(OH)2��C�Լ�Fe�����������)��ȡ���·�(ZnS��BaSO4)������ȡǦ�Ĺ����������£�
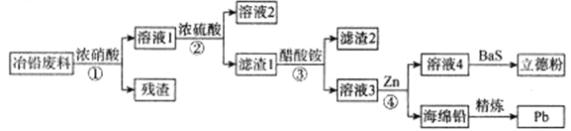
��֪��
�ٴ���Ǧ������ˮ���ѵ��롣
�ڳ����£�Ksp(PbSO4)=1.6��10��8��Ksp(PbCO3)=8.0��10��14��
�ش��������⣺
(1)Ϊ�˼ӿ�ٵķ�Ӧ���ʣ�ͨ��ѡ��6mol/L�������60��ķ�Ӧ���������¶ȼ������ߣ����������ڷ�Ӧ�Ľ��У�ԭ�������___________��
(2)���������ʵ���ҽ��з����������IJ���������___________������1����Ҫ�ɷ�������Ǧ��ϴ������Ǧ���ѡ��___________��
A.����ˮ B.�� C.ϡ���� D.����̼����
(3)д������۷�Ӧ�����ӷ���ʽ___________��
(4)���õ�ⷨ����Ǧ������Ǧ���ӵ�Դ��___________��(��������)������Ǧ�ĵ缫��ӦʽΪ___________��
(5)������Ǧ����1t(��Ǧ��PbO�ƣ���������Ϊ11.15%)����������Ϊ90%����õ���Ǧ����___________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH4-CO2�������������Եõ��ϳ���CO��H2��������������ļ��ž�����Ҫ���塣
��֪��C(s)+2H2(g)=CH4(g) ��H1 K1 C(s)+O2(g) =CO2(g) ��H2 K2 ��C(s)+![]() O2(g) =CO(g) ��H3 K3��CH4-CO2��������ӦΪ��CH4(g)+CO2(g)=2CO(g)+2H2(g) ��H K(������HΪ�ʱ䣬KΪƽ�ⳣ��)����˵����ȷ����
O2(g) =CO(g) ��H3 K3��CH4-CO2��������ӦΪ��CH4(g)+CO2(g)=2CO(g)+2H2(g) ��H K(������HΪ�ʱ䣬KΪƽ�ⳣ��)����˵����ȷ����
A. ��H=2��H3��2��H2����H1
B. K=2K3��K2��K1
C. ��ƽ��ʱc(CH4)��c(CO2)��c(CO)��c(H2)=1��1��1��1����Kһ������1(mol/L)2
D. ��Сѹǿ������CH4(g)��CO2(g)��ƽ��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ұ�ΪԪ�����ڱ�ǰ�����ڵ�һ���֣������й�W��X��Y��Z��R����Ԫ�ص������У���ȷ���ǣ� ��
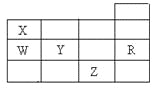
A. �����£�Z����Ϊ��̬����
B. Y��Z�������ӵ��Ӳ�ṹ����Rԭ�ӵ���ͬ
C. W���⻯����ȶ���Ҫ��X���⻯����ȶ���ǿ
D. YԪ�صķǽ����Ա�WԪ�صķǽ�����ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�У��������Ӽ������Լ����Ǽ��Լ����ѣ��������Ӽ������Լ����Ǽ��Լ��γɵ��ǣ� ��
A. NH4Cl+NaOH��NaCl+NH3![]() +H2O B. Mg3N2+6H2O��3Mg(OH)2+2NH3
+H2O B. Mg3N2+6H2O��3Mg(OH)2+2NH3![]()
C. Cl2+2NaOH��NaClO+NaCl+H2O D. 2Na2O2+2H2O��NaOH+O2![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
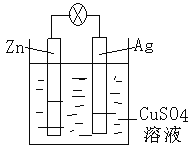
����Ŀ����1��ȼ�ϵ����һ�ָ�Ч�������Ѻõķ���װ�á�����ȼ�ϵ�������ں���ɻ���������������ҺΪ�������Һ�����ֵ�صĸ�����ӦʽΪ_______________�����ֵ���ڷŵ�ʹ��һ��ʱ��������Һ�е�c��OH������___________���������С�� ���䡱����
��2����ͼ����пԭ���װ�õ�ʾ��ͼ��������ͭΪ�������Һ���ش��������⣺пΪ_______�����õ缫�Ϸ���_________��Ӧ������������ԭ�������缫��ӦʽΪ__________����ԭ��ص��ܷ�Ӧ���ӷ���ʽΪ__________________________________��
��.һ���¶��½�6mol��A��6molB�����2L���ܱ�������,�������·�:3A��g��+B��g��![]() xC��g��+2D��g��,����5���Ӻ�Ӧ�ﵽƽ��,���A��ת����Ϊ60%,C��ƽ����Ӧ������0.36mol/��L��min������:
xC��g��+2D��g��,����5���Ӻ�Ӧ�ﵽƽ��,���A��ת����Ϊ60%,C��ƽ����Ӧ������0.36mol/��L��min������:
��1��ƽ��ʱD��Ũ��=________��
��2��B��ƽ����Ӧ����v��B��=____________��
��3��x=________________��
��4����ʼʱ�����е�ѹǿ��ƽ��ʱ��ѹǿ֮��Ϊ_______����Ϊ��������ȣ���
��5����NH3���������з�ȼ�ϵ���ǵ�ǰ���е�һ���ȵ㡣ʹ�õĵ������Һ��2mol��L-1��KOH��Һ������ܷ�ӦΪ��4NH3+3O2��2N2+6H2O���õ�ظ����ĵ缫��Ӧ__________��ÿ����3.4gNH3ת�Ƶĵ�����ĿΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���a( )��b(
)��b(![]() ��CH3)��c(
��CH3)��c(![]() )��˵����ȷ����
)��˵����ȷ����
A. a��b��Ϊͬ���칹�� B. b��c�����ڷ��㻯����
C. c����������̼ԭ�ӹ�ƽ�� D. a��b��c��������ˮ��Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com