
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )
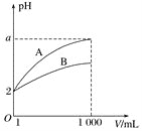
A.A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液的酸性强
C.a=5时,A是强酸,B是弱酸
D.一定有关系:5>a>2
【答案】C
【解析】
由图可知,稀释相同的倍数,A的变化大,则A的酸性比B的酸性强;溶液中氢离子浓度越大,酸性越强,对于一元强酸:c(酸)=c(H+),但对于一元弱酸:c(酸)>c(H+),据此分析解答。
A.因A、B酸的强弱不同,对于一元强酸来说c(酸)=c(H+),对于一元弱酸,c(酸)>c(H+),则A、B两种酸溶液的物质的量浓度一定不相等,故A错误;
B.由图可知,稀释后,B的pH小,c(H+)大,则稀释后B酸的酸性强,故B错误;
C.由图可知,若a=5,A完全电离,则A是强酸,B的pH变化小,则B为弱酸,故C正确;
D.若A和B都是弱酸,加水稀释时促进弱酸电离,所以溶液中pH为5>a>2,但A为强酸时,a=5,则5≥a>2,故D错误;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
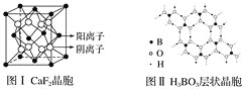
图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积固定的V L密闭容器中加入n mol A.2n mol B,发生反应:A(g)+2B(g) ![]() 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。
A.物质A.B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=________。在保证A浓度不变的情况下,扩大容器的体积,平衡______(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)该反应的逆反应速率与时间的关系如图所示。
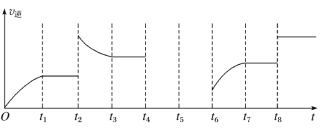
①由图可知,反应在t1.t3.t7时都达到了平衡,而t2.t8时都改变了一种条件,试判断改变的条件:t2时_______________________;t8时_________________________。
②t2时平衡向___________________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘酸钾(KIO3)是重要的食品添加剂。某化学兴趣小组设计下列步骤制取KIO3,并进行产品的纯度测定。
制取碘酸(HIO3)的实验装置示意图和有关资料如下:
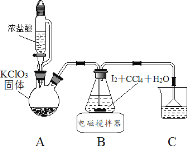
HIO3 | ①白色固体,能溶于水,难溶于四氯化碳 ②Ka=0.169mol·L-1 |
KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生反应: ClO-+ IO3- =IO4 -+ Cl- |
回答下列问题:
步骤Ⅰ用 Cl2 氧化 I2 制取 HIO3
(1)装置 A 中发生反应的化学方程式_______。
(2)装置 B 中的 CCl4 可以加快反应速率,原因_______。
(3)反应结束后,获取 HIO3 溶液的操作中,所需玻璃仪器有烧杯、________和_______。
步骤Ⅱ用 KOH 中和 HIO3 制取 KIO3
(4)该中和反应的离子方程式为_______。中和之前,应将上述 HIO3溶液煮沸至接近无色,否则中和时易生成_______(填化学式)而降低 KIO3 的产量。
(5)往中和后的溶液中加入适量_______,经搅拌、静置、过滤等操作,得到白色固体。
(6)为验证产物,取少量上述固体溶于水,滴加适量 SO2 饱和溶液,摇匀,再加入几滴淀粉溶液,溶液变蓝。若实验时,所加的 SO2 饱和溶液过量,则无蓝色出现,原因是_______。
步骤Ⅲ纯度测定
(7)取 0.1000 g 产品于碘量瓶中,加入稀盐酸和足量 KI 溶液,用 0.1000 mol·L-1Na2S2O3溶液滴定,接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失(I2+2S2O32-=2I-+S4O62-)。进行平行实验后,平均消耗 Na2S2O3 溶液的体积为 24.00 mL。则产品中 KIO3 的质量分数为_______。[M(KIO3)=214.0 g·mol-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是
A. 红棕色的NO2加压后颜色先变深后变浅
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C. 黄绿色的氯水光照后颜色变浅
D. 合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能的优点是燃烧热值高,无污染。目前工业制氢气的一个重要反应为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH,反应过程和能量的关系如图所示:
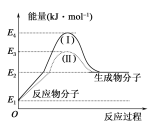
(1)CO(g)+H2O(g)===CO2(g)+H2(g) ΔH______(填“>”“<”或“=”)0。
(2)过程Ⅱ是加入催化剂后的反应过程,则过程Ⅰ和Ⅱ的反应热________(填“相等”或“不相等”),原因是____________________________________________________________________。
(3)已知:H2(g)+![]() O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
则H2(g)燃烧生成H2O(l)的热化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
B.32.5gFeCl3水解形成的Fe(OH)3胶体粒子数为0.2NA
C.标准状况下,4.48L氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为0.1NA
D.密闭容器中2molNO与lmolO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH 溶液中有1% CH3COOH 分子发生电离,则溶液的pH=______________;可以使0.10mol·L-1 CH3COOH的电离程度增大的是____________。、
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1. d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH 均等于3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液有锌粉剩余,则生成氢气的体积:V( 盐酸)________V(醋酸)(填“>”、“ <” 或“=”)。
(3)0.1mol/L 的某酸H2A 的pH=4,则H2A 的电离方程式为_________________。
(4)某温度下,Kw=1×10-12,将0.02mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混和液的pH=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com