
| A. | H2O | B. | HCl | C. | NaCl | D. | CO2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,铵根离子和酸根离子之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:A.水分子中H-O原子之间只存在共价键,为共价化合物,故A错误;
B.HCl分子中H-Cl原子之间只存在共价键,为共价化合物,故B错误;
C.NaCl中钠离子和氯离子之间存在离子键,为离子化合物,故C正确;
D.二氧化碳分子中C、O原子之间只存在共价键,为共价化合物,故D错误;
故选C.
点评 本题考查离子化合物和共价化合物判断,为高频考点,明确物质构成微粒及微粒之间作用力是解本题关键,题目难度不大,侧重于考查学生对基础知识的应用能力.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
 若用AG来表示溶液的酸度,其表达式为:AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].298K时,用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
若用AG来表示溶液的酸度,其表达式为:AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].298K时,用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )| A. | 该滴定实验最好选择酚酞作为指示剂 | |
| B. | C点时加入盐酸溶液的体积等于10 mL | |
| C. | 滴定过程中从A点到D点,溶液中水的电离程度先逐渐减小,后逐渐增大 | |
| D. | 若B点加入的盐酸溶液体积为5mL,则所得溶液中:c(M+)+2c(H+)═c(MOH)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是高分子化合物 | |
| B. | 氨基酸和蛋白质既能与酸反应,又能与碱反应 | |
| C. | 甲酸乙酯、葡萄糖、麦芽糖、淀粉这四种物质的共同性质是他们既可以发生水解反应,又可以发生银镜反应 | |
| D. | 蛋白质溶液遇硫酸铜产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对硫一氮化合物的研究是最为活跃的领域之一.如图是已经合成典型的硫-氮化合物的分子结构.下列说法正确的是( )
对硫一氮化合物的研究是最为活跃的领域之一.如图是已经合成典型的硫-氮化合物的分子结构.下列说法正确的是( )| A. | 该物质的分子式为SN | B. | 该物质具有很高的熔、沸点 | ||
| C. | 该分子是非平面的八元环结构 | D. | 该物质与S2N2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$ I | |
| B. | N2的电子式: | |
| C. | S2-的结构示意图: | |
| D. | 甲烷分子的比例模型是  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
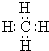 ,AxByCz的分子式AlC3H9.
,AxByCz的分子式AlC3H9.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com