
【题目】下列解释实验事实的方程式正确的是
A.氯气能使湿润的有色布条褪色:Cl2+H2O![]() 2H+ + Cl + ClO
2H+ + Cl + ClO
B.Na2S 溶液显碱性:S2- + 2H2O![]() H2S↑+ 2OH-
H2S↑+ 2OH-
C.用氨水吸收烟气中的二氧化硫:SO2 + 2OH- = SO![]() + H2O
+ H2O
D.铜片溶解在NaNO3 和稀盐酸的混合液中:3Cu + 8H+ + 2NO![]() =3Cu2+ + 2NO↑ + 4H2O
=3Cu2+ + 2NO↑ + 4H2O
【答案】D
【解析】
A.氯气与水反应生成盐酸和次氯酸,次氯酸是弱酸,不能拆写,反应的离子方程式为Cl2+H2O![]() H+ +Cl+HClO,故A错误;
H+ +Cl+HClO,故A错误;
B.硫化钠是强碱弱酸盐,硫离子在溶液中分步水解,使溶液呈碱性,水解的离子方程式为S2-+ H2O![]() HS-+ OH-,故B错误;
HS-+ OH-,故B错误;
C.用氨水吸收烟气中的二氧化硫的反应为一水合氨与二氧化硫反应生成亚硫酸铵和水,一水合氨是弱碱,不能拆写,反应的离子方程式为SO2+ 2NH3·H2O= SO32—+2NH4++ 2H2O,故C错误;
D.铜片溶解在NaNO3 和稀盐酸的混合液中的反应为铜与稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为3Cu + 8H++ 2NO3—=3Cu2++ 2NO↑ + 4H2O,故D正确;
故选D。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,测得C的浓度为0.2mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,测得C的浓度为0.2mol·L-1。下列判断错误的是( )
A.x=1
B.B的转化率为40%
C.2min内A的反应速率为0.6mol·L-1·min-1
D.若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某NaOH试样中含有NaCl杂质,为测定试样中 NaOH 的质量分数,进行如下步骤实验:
① 称量 1.0g 样品溶于水,配成 250 mL 溶液;
② 准确量取 25.00 mL 所配溶液于锥形瓶中;
③ 滴加几滴酚酞溶液;
④ 用 0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答:
(1)称量1.0g 样品,除小烧杯、药匙外,所用到的主要仪器有_________。
(2)将样品配成 250 mL 溶液,除小烧杯、玻璃棒外,还需用到的玻璃仪器有_________。
(3)用_________滴定管(填“酸式”或“碱式”)盛装 0.10mol/L 的盐酸标准液。
(4)观察滴定到终点时溶液颜色的变化为_________。
(5)烧碱样品的纯度为_________。
(6)若出现下列情况,测定结果偏高的是_________。
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.盛装标准液的滴定管水洗后未用标准液再润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2D(g)△H=QkJ/mol。相关条件和数据见下表:
2D(g)△H=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验I | 实验II | 实验III |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 50 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是
A. 升高温度能加快反应速率的原理是降低了反应的活化能,使活化分子百分数提高
B. 实验III达平衡后,保持其他条件不变,再向容器中通入1molA和1molD,平衡不移动
C. 实验III达平衡后容器内的压强是实验1的9/10倍
D. K3>K2>K1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO2 ![]() 2NO+O2(正反应吸热)。实验测得:
2NO+O2(正反应吸热)。实验测得:![]() ,
,![]() ,
,![]() 为速率常数,受温度影响。 下列说法正确的是
为速率常数,受温度影响。 下列说法正确的是
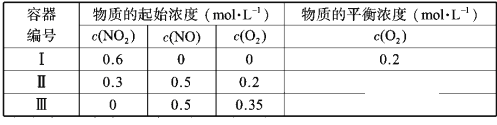
A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C. 达平衡时,容器Ⅲ中![]() 的体积分数大于50%
的体积分数大于50%
D. 当温度改变为![]() 时,若
时,若![]() ,则
,则 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年8月3日我国确诊首例非洲猪瘟疫情。目前某有效药物的主要成分——姜黄素(分子式为C12H20O6)的一种合成路线如图所示:
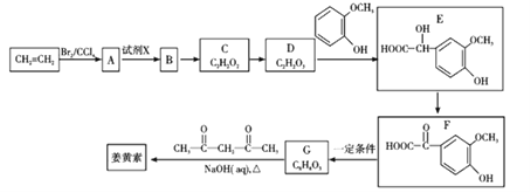
已知:
①![]()
![]() CH3CHO+CO2↑
CH3CHO+CO2↑
②CH3CHO+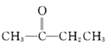
![]()
![]() +H2O
+H2O
回答下列问题:
(1)A的名称为_________;试剂X为_________。
(2)D中含有的官能团名称为_________。
(3)反应D→E的化学方程式为______________________________,其反应类型是________。
(4)下列有关G(C8H8O3)的叙述不正确的是_________(填正确答案编号)。
a.能与NaHCO3溶液反应 b.能与浓溴水发生取代反应
c.能与FeCl3溶液发生显色反应 d.l mol G最多能与3 mol H2发生加成反应
(5)姜黄素的结构简式为_________。
(6)G(C8H8O3)的同分异构体中,写出同时符合下列条件的结构简式为_________。
①苯环上的一取代物只有2种;
②核磁共振氢谱中有4组吸收峰;
③l mol该物质与烧碱溶液反应,最多消耗3 mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Ka(HCOOH)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 混合溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( )
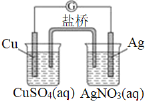
①铜电极的质量减少②正极反应为Ag++e-=Ag ③在外电路中,电流由铜电极流向银电极 ④实验过程中取出盐桥,原电池仍继续工作
A.①②B.②③C.②④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是___________价,其基态原子电子排布式为___________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4,溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是___________。
②除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为___________。
③NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为___________。但NF3不易与Cu2+形成化学键,其原因是___________。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。
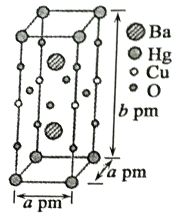
①该物质的化学式为___________。
②已知该晶胞中两个Ba2+的间距为cpm。则距离Ba2+最近的Hg+数目为___________个,二者的最短距离为___________pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏加德罗常数的值为NA,则该晶体的密度为___________g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com