
| 3.9g |
| 78g/mol |
| 0.15mol |
| 1mol/L |
| 0.35mol |
| 1mol/L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B、硬度由大到小:金刚石>碳化硅>晶体硅 |
| C、熔点由高到低:Na>Mg>Al |
| D、熔点由高到低:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石>晶体硅>二氧化硅>碳化硅 |
| B、MgO>O2>N2>H2O |
| C、CI4>CBr4>CCl4>CH4 |
| D、金刚石>生铁>纯铁>钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 |
| B、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子还小 |
| C、石油裂化的主要是提高汽油的产量,石油裂解的主要是得到更多的乙烯 |
| D、一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O3和O2互为同位素 |
| B、O2和H2O2的分子内都含有共价键 |
| C、H2O2具有氧化性,可以用于消毒杀菌 |
| D、高空中的O3层保护人类免受紫外线伤害 |
查看答案和解析>>
科目:高中化学 来源: 题型:
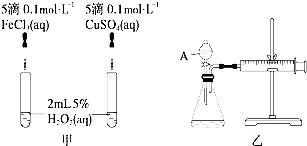 过氧化氢又名双氧水,具有较强的氧化性和还原性,在日常生活和生产中有重要用途.其电子式为
过氧化氢又名双氧水,具有较强的氧化性和还原性,在日常生活和生产中有重要用途.其电子式为查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com