
| A. | ①③②④ | B. | ③①④② | C. | ④③②① | D. | ④③①② |
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:推断题
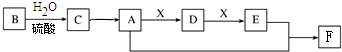
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
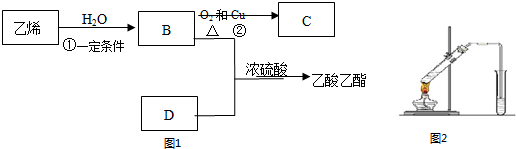
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极得电子,质量减轻 | |
| B. | 放电时电解质溶液中的OH-向正极移动 | |
| C. | 充电时阴极附近溶液的pH减小 | |
| D. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2、I2和 HI 分子中的化学键都是非极性共价键 | |
| B. | 断开 2 mol HI 分子中的化学键所需能量约为(c+b+a) kJ | |
| C. | 相同条件下,1 mol H2(g)和 1mol I2(g)总能量小于 2 mol HI (g)的总能量 | |
| D. | 向密闭容器中加入 2 mol H2(g)和 2 mol I2(g),充分反应后放出的热量为 2a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
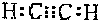 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
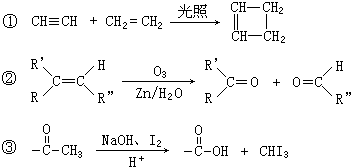
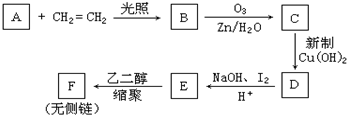
 ,CCH3COCH2CH2CHO,DCH3COCH2CH2COOH,F
,CCH3COCH2CH2CHO,DCH3COCH2CH2COOH,F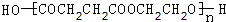 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g Fe和一定量的浓HNO3或稀硝酸完全反应,转移电子均为0.3 NA | |
| B. | 16 g氧气或臭氧的氧原子个数均为NA | |
| C. | 1 mol金刚石中含有的C-C键为4NA | |
| D. | 28.6 g Na2CO3•10H2O在晶体中或溶液中,含有的CO32-离子均小于0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com