
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量简量取30mL0.50 molL-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.50molL-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)如果用30mL0.50mol/L硫酸与70mL0.50mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___________(填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”),简述理由_____________________。
(2)某实验小组配制0.50mol/LNaOH溶液,若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体_____________________g。
(3)若用KOH代替NaOH,对测定结果___________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果_____________(填“有”或“无”)影响。
(4)①近似认为0.50 molL-1硫酸和0.50 molL-1NaOH溶液密度都是1g·cm3,中和后溶液温度上升了4℃,生成溶液的比热容c=4.18J·(g·℃)-1,则中和热△H=______(小数点后保留一位有效数字)。
②上述实验结果与-57.3kJ·mol-1有偏差,产生偏差的原因可能是____________(填字母)。
A.实验装置保温隔热效果差
B.量取NaOH溶液体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
【答案】 不相等 相等 中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关 5.0 无 有 -53.5kJ·mol-1 ACD
【解析】本题主要考查测定中和热实验。
(1)如果用30mL0.50mol/L 硫酸与70mL0.50mol/LNaOH 溶液进行反应,与上述实验相比,参加反应的酸碱多少不同,所放出的热量不相等,所求中和热相等,简述理由:中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关。
(2)某实验小组配制0.50mol/LNaOH溶液,若实验中大约要使用245mLNaOH溶液,需要选择250mL容量瓶配制溶液,至少需要称量NaOH固体0.5mol/L×0.25L×40g/mol=5.0g。
(3)若用KOH代替NaOH,对测定结果无影响;若用醋酸代替HCl做实验,醋酸电离吸热,对测定结果有影响。
(4)①中和热△H=4℃×4.18J·(g·℃)-1×80g/0.025mol=53.5kJ·mol-1。
②A.热量散失,温度上升值减小,测定结果偏小;B.NaOH溶液体积增大,温度上升值增大,测定结果偏大;C. 热量散失,温度上升值减小,测定结果偏小;D. 热量散失,温度上升值减小,测定结果偏小。故选ACD。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下Kb(NH3·H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是( )

A. 0.1mol·L-1HR溶液的pH约为5 B. HR为弱酸,常温时Ka(HR)=1.0×10-7
C. 当通入0.1molNH3时,溶液中c(R-)<c(NH4+) D. 当c(HR)=c(R-)时,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H5OH表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是

A. 右室电极为该电池的正极
B. 左室电极反应式可表示为:C6H5OH-28e-+11H2O=6CO2↑+28H+
C. 右室电极附近溶液的pH减小
D. 工作时左侧离子交换膜为阴离子交换膜,右侧离子交换膜为阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾常用作消毒剂、水质净化剂等。工业上用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)制备高锰酸钾晶体的一种工艺流程如下:
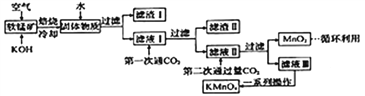
回答下列问题:
(1)焙烧过程中发生的主要反应为MnO2+KOH+O2![]() K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
(2)滤渣Ⅱ是________,第一次通CO2不能用稀盐酸代替的原因是____________________________。
(3)第二次通入过量CO2生成MnO2的离子方程式为__________________________。
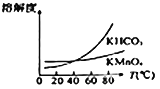
(4)由下图可知,从滤液Ⅲ得到高锰酸钾晶体需经过________、________、洗涤等一系列操作。
(5)1t含MnO287%的软锰矿,理论上最多可制得________tKMnO4晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列实验方法操作,能达到要求的是( )
A.用托盘天平称量25.20g氯化钠固体
B.实验室制取蒸馏水时,圆底烧瓶中加些碎瓷片可防止暴沸
C.加热饱和FeCl3溶液制备Fe(OH)3胶体
D.将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在无色溶液中大量共存的一组离子是( )
A.Cu2+、SO42﹣、OH﹣、K+
B.Fe3+、NO3﹣、Cl﹣、H+
C.K+、CO32﹣、Cl﹣、H+
D.H+、Na+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】r—Fe2O3是一种具有磁性、催化、气敏的纳米材料。一种以硫铁矿烧渣等为原料制备r—Fe2O3的流程如下:

(1)下列有关“还原焙烧”工序的说法正确的是_____(填字母)。
a.焦炭应少量,空气应过量
b. 焙烧过程均为吸热反应,需用电炉持续加热反应器
c.“还原焙烧”的主要反应为 3C+2O2![]() 2CO+CO2、Fe2O3+CO
2CO+CO2、Fe2O3+CO![]() 2FeO+CO2
2FeO+CO2
(2)“浸取”前需将焙烧生成的熔体粉碎,其目的是_____________________。
(3)已知三种金属离子开始沉淀和完全沉淀的pH如下表:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀的pH | 2.2 | 7.5 | 4.1 |
完全沉淀的pH | 3.5 | 9.5 | 5.4 |
则“调pH”时,溶液的pH范围为_______________。
(4)滤渣1的主要成分为_________(填化学式);“沉铁”时发生反应的离子方程式为___________。
(5)“过滤2”时需用蒸馏水洗涤,能证明沉淀已洗涤干净的方法是_________;沉淀缓慢氧化为铁黄的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用乙烯和乙醇为原料制取草酸二乙酯的过程中发生的反应类型及顺序正确的是
①酯化反应 ②氧化反应 ③水解反应 ④加成反应
A. ②④③① B. ④①②③ C. ④③②① D. ②③①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】下列描述中正确的是 ( )
A. 纯碱溶于热水后去污效果增强,说明纯碱的水解反应是吸热反应
B. NH3(g) + HCl(g) = NH4Cl(s) 在较低温度下能自发进行,说明该反应的ΔH>0
C. 500℃、30 MPa下,将7 g N2和3 g H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
D. 甲烷的燃烧热(ΔH)为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com