
【题目】(1)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g) +1/2O2(g)![]() SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _____v(逆)(填“<”、“>”或“=”)。
SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _____v(逆)(填“<”、“>”或“=”)。
(2)下表列出了常见的烟气脱硝的两种方法
编号 | 名称 | 原理 |
方法一 | 尿素法 | 在温度70—95℃时,尿素CO(NH2)2溶液吸收NO、NO2,将其转化为N2 |
方法二 | 选择性催化还原( SCR)法 | 以NH3等作为还原剂,将烟气中的NOx还原生成N2和H2O |
已知:N2(g)+O2(g)=2NO(g) △H=+180.6 kJ·mol—1
N2(g)+3H2(g)=2NH3(g) △H= -92.4kJ·mol—1
2H2(g)+O2(g)=2H2O(g)△H= -483.6 kJ·mol—1
则4NO(g) +4NH3(g)+O2(g)=4N2(g)+6H2O(g);△H=_________ kJ·mol-1。
(3)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g);ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g);ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。

①该反应的ΔH_______0(选填“<”、“>”或“=”,下同),K1_________K2。
②将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有___。
【答案】 > 1627.2 < > 升温或减压
【解析】(1)向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),三种物质的浓度分别为0.03mol/L、0.16mol/L、0.03mol/L,某温度下该反应的平衡常数K=![]() ,因为浓度商Qc=
,因为浓度商Qc=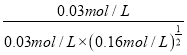 =2.5>K,所以化学反应正向进行,即v(正)>v(逆),故答案为:>;
=2.5>K,所以化学反应正向进行,即v(正)>v(逆),故答案为:>;
(2)已知:①N2(g)+O2(g)═2NO(g)△H=+180.6kJmol-1,②N2(g)+3H2(g)=2NH3(g) △H=-92.4kJmol-1,③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJmol-1,依据盖斯定律③×3-②×2-①×2得到,4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=-1627.2kJ/mol,故答案为:-1627.2;
(3)①图1可以看出,甲醇的物质的量为0.6mol的曲线温度大,说明升高温度,甲醇的物质的量减少,即平衡逆向移动,说明正反应是放热反应,所以△H<0;因正反应是放热反应,温度降低,平衡正向移动,平衡常数增大,所以说低温时平衡常数大;故答案为:<;>;
②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g),ΔH<0,因正反应为放热反应,升高温度,平衡逆向移动,甲醇的体积分数减小,减小压强,平衡逆向移动,甲醇的体积分数减小,将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压,故答案为:升温或减压。
CH3OH(g),ΔH<0,因正反应为放热反应,升高温度,平衡逆向移动,甲醇的体积分数减小,减小压强,平衡逆向移动,甲醇的体积分数减小,将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压,故答案为:升温或减压。


科目:高中化学 来源: 题型:
【题目】下列物质中,分子的一端亲水,另一端亲油的是( )
A.CH3(CH2)15SO3Na
B.CH2CH2CH3
C.CCl4
D.CH3(CH2)4CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将4 mol PCl3和2 mol Cl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2PCl5,各物质均为气态。达平衡后,PCl5为0.8 mol。若此时再移走2 mol PCl3和1 mol Cl2,相同温度下达到平衡,PCl5的物质的量为
A. 0.8 mol B. 0.4 mol C. 0.4 mol<x<0.8 mol D. <0.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等。已知:Ce4++Fe2+=Ce3+ +Fe3+。下列说法正确的是
A. 可用电解熔融CeO2制取金属铈,铈在阳极生成
B. ![]() 、
、![]() 是同素异形体
是同素异形体
C. 铈的原子核外有58个电子
D. 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaClO、NaClO3的混合液,经测定ClO﹣和ClO3﹣的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为( )
A.21:5
B.11:3
C.3:1
D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质结构和性质变化规律正确的是( )
A.硬度:LiCl<NaCl<KClB.沸点:HF<HCl<HBr
C.酸性:H3PO4>H2SO4>HClO4D.原子半径:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法中不符合“绿色化学”思想的是( )
A.以水性涂料代替油性涂料
B.以无磷洗涤剂代替含磷洗涤剂
C.实验后的有毒有害物质应分类收集、统一处理
D.在通风橱中制氯气时不用NaOH溶液吸收尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com