
| A、混合气体的密度 |
| B、混合气体的总物质的量 |
| C、混合气体的平均相对分子质量 |
| D、体系的温度不变 |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
| A、1:1 | B、5:16 |
| C、2:3 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨气的制取及性质探究(图中夹持装置均已略去).
氨气的制取及性质探究(图中夹持装置均已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑥ | B、②③⑤ |
| C、①③⑥ | D、②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、红棕色的NO2,加压后颜色先变深后变浅 |
| B、高压比常压有利于合成SO3的反应 |
| C、加入催化剂有利于氨的合成 |
| D、工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
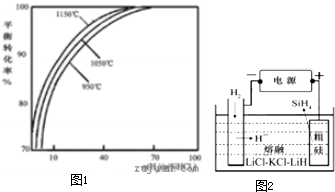 多晶硅是太阳能光伏产业的重要原料.
多晶硅是太阳能光伏产业的重要原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com