
【题目】
(1)计算需要NaOH固体质量 g。
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒⑥托盘天平 ⑦量筒。配制以上两种溶液必须使用的玻璃仪器 (填序号),还缺少的仪器是 。
(3)定容的具体操作方法是: 。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL,如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好。
(5)配制过程中,下列操作会引起结果偏高的是 (填序号)
①未洗涤烧杯、玻璃棒 ②称量NaOH的时间太长
③定容时俯视刻度 ④容量瓶不干燥,含有少量蒸馏水
⑤NaOH溶液未冷却至室温就转移到容量瓶 ⑥量取浓硫酸时,仰视量筒刻度线
【答案】(1)8.0(2)①④⑤,胶头滴管
(3)将水沿玻璃棒注入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
(4)13.6;15(5)③⑤⑥
【解析】试题分析:(1)实验需要0.4mol/LNaOH溶液480ml,而实验室没有480mL容量瓶,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM可知需要氢氧化钠的质量m=0.4mol/L×40g/mol×0.5L=8.0g;故答案为:8.0;
(2)实验需要0.1mol/LNaOH溶液480ml,需要配制500mL的溶液,需要的仪器有托盘天平、烧杯、胶头滴管、玻璃棒、500mL容量瓶,所以还缺少的仪器有:胶头滴管,故答案为:①④⑤; 胶头滴管;
(3)定容的具体操作方法是将水沿玻璃棒注入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线,故答案为:将水沿玻璃棒注入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线;
(4)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度=![]() =18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.5/L×0.5L,V=0.0136L=13.6mL,应选择15ml量筒;故答案为:13.6;15;
=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.5/L×0.5L,V=0.0136L=13.6mL,应选择15ml量筒;故答案为:13.6;15;
(5)①未洗涤烧杯、玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低;②称量NaOH的时间太长,导致氢氧化钠吸收水、二氧化碳,实际称取的固体中含有氢氧化钠的物质的量偏小,溶液浓度偏低;③定容时俯视刻度,导致溶液体积偏小,溶液浓度偏高;④容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不受影响;⑤NaOH溶液未冷却至室温就转移到容量瓶,冷却后溶液液面下降,溶液体积偏小,溶液浓度偏高;⑥量取浓硫酸时,仰视量筒刻度线,导致浓硫酸的体积偏高,溶质的物质的量偏大,浓度偏高,故答案为:③⑤⑥。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)铁元素在周期表中的位置是 ,铜的基态原子核外电子排布式为 ,元素铁与铜的第二电离能分别为:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu比IFe大得多的原因是 。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为______________。
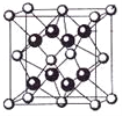
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:

图中虚线表示_____________,SO42-的立体构型是__________,其中S原子的杂化轨道类型是___________;O原子的价电子排布图为__________________。
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为 。
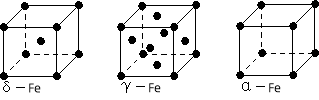
(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中原子之间的作用力是_______________。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如右图)相似,该晶体储氢后的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-。将该混合物溶于水后得澄清溶液,现取3份 100 mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
1 | 加入AgNO3溶液 | 有白色沉淀生成 |
2 | 加入足量NaOH溶液并加热 | 收集到气体0.896L(换算成标准状况) |
3 | 加入足量BaCl2溶液,,将所得沉淀洗涤、干燥、称重;再向沉淀中加足量的稀盐酸,洗涤、干燥、称重 | 第一次称重读数为6.27g,第二次称重读数为2.33g |
已知加热时NH4++OH-![]() NH3↑+H2O,回答下列问题:
NH3↑+H2O,回答下列问题:
(1)判断混合物中Cl-是否一定存在 _。(填“是”或“否”)
(2)写出溶液中一定存在的离子及其物质的量浓度: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学以碳棒为电极电解CuCl2溶液时,发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,同学们阅读资料并设计了如下过程:
Ⅰ.有关资料:铜的化合物颜色性质如下
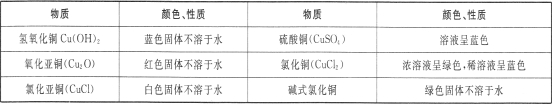
Ⅱ.探究实验:
(1)提出假设
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为。
(2)实验验证
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物,
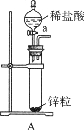
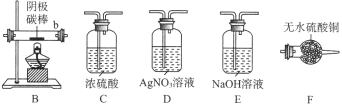
①实验前,检查装置A气密性的方法是。
②实验时,各装置从左至右的连接顺序为A→→→B→→。
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象①碳棒上的红色物质是否有Cu2O(填“是”或“否”),理由是;②装置(填上图中装置编号)中的现象说明提出假设②中的白色物质一定存在;③写出装置b中发生反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp (25 ℃)如下:
AgCl | AgI | Ag2S | |
Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水中存在平衡:H2O![]() H++OH- ΔH>0,下列叙述正确的是
H++OH- ΔH>0,下列叙述正确的是
A.加入稀氨水,平衡逆向移动,c(OH-)降低,Kw不变
B.加入少量固体CuSO4,c (H+)增大,Kw不变
C.加入少量固体CH3COONa,平衡逆向移动,c(H+)降低,Kw不变
D.加热到90℃,Kw增大,溶液仍呈中性,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇(C14H12O3)是一种天然的肿瘤化学预防剂,来源于花生、葡萄和桑葚等植物。该物质属于
A. 无机物 B. 有机物 C. 单质 D. 氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如下图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如下图所示,下列叙述正确的是
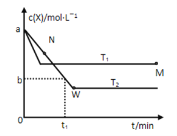
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)=![]() mol·L-1·min-1
mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,AG=lg![]() 。下列叙述中正确的是( )
。下列叙述中正确的是( )
①任何温度下,纯水的AG等于0
②溶液的AG越小,酸性越强
③25 ℃时,0.1 mol·L-1盐酸的AG=12
④25 ℃时,某溶液的AG=-10,其pH=10
A.①③ B.②④
C.①② D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com