
| A. | 与足量的澄清石灰水反应的现象不同 | |
| B. | 通入BaCl 2溶液时现象相同 | |
| C. | 通入Ba(NO3)₂溶液时现象相同 | |
| D. | 通入石蕊溶液时现象相同 |
分析 A.二氧化硫、二氧化碳通入到澄清石灰水分别反应生成亚硫酸钙、碳酸钙,继续通入相应气体,分别得到亚硫酸氢钙、碳酸氢钙;
B.盐酸酸性强于碳酸和亚硫酸;
C.二氧化硫具有还原性,能够被硝酸根离子氧化生成硫酸根离子;
D.二氧化碳、二氧化硫都是酸性氧化物,能够与水反应生成对应的酸,溶液显酸性.
解答 解:A.二氧化硫、二氧化碳通入到澄清石灰水分别反应生成亚硫酸钙、碳酸钙,继续通入相应气体,分别得到亚硫酸氢钙、碳酸氢钙,二者现象相同:先产生沉淀,然后沉淀溶解,故A错误;
B.盐酸酸性强于碳酸和亚硫酸,依据强酸制备弱酸规律,CO2和SO2气体通入BaCl 2溶液,都不反应,故B正确;
C.二氧化碳通入硝酸钡溶液不发生反应,二氧化硫通入硝酸钡反应生成硫酸钡沉淀,二者现象不同,故C错误;
D.二氧化碳、二氧化硫都是酸性氧化物,能够与水反应生成对应的酸,溶液显酸性,都能使石蕊显红色,故D正确;
故选:AC.
点评 本题考查了元素化合物知识,明确二氧化碳、二氧化硫的性质是解题关键,题目难度不大,注意二氧化硫的酸性氧化物的性质.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向氯水中加入硝酸银溶液,有白色沉淀产生 | 氯水中已无Cl2 |
| B | 将SO2通入酸性高锰酸钾溶液,溶液紫色褪去 | SO2具有漂白性 |
| C | 向FeCl3和CuCl2混合溶液中加入少量铁粉,没有红色固体析出 | 氧化性:Fe3+>Cu2+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
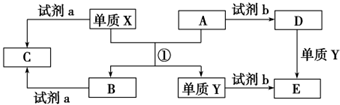
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )
A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )| A. | 4.32 g | B. | 2.16 g | C. | 1.08 g | D. | 0.54 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
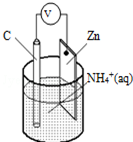
| A. | 碳为电池的负极 | B. | Zn极上发生氧化反应 | ||
| C. | 电流由锌极流向碳极 | D. | H2在Zn片上生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 神州宇宙飞行器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意如图:
神州宇宙飞行器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
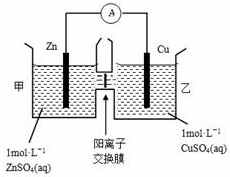
| A. | 铜电极上发生氧化反应 | |
| B. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| C. | 电池工作一段时间后,乙池的c(Zn2+)>c(SO42-) | |
| D. | 阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
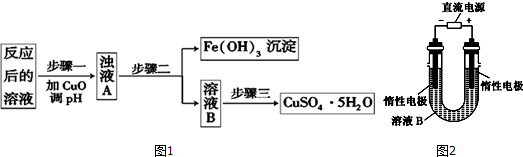
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 当m2-m3=2.96 g时,Fe3O4的质量至少为2.32g | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 要确定混合物中是否含有Al,可取A加入适量稀盐酸 | |
| D. | 当m1>m2时,溶液a中的阴离子只有1种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com