
| A. | 2.4mol/L | B. | 1.4mol/L | C. | 1.2mol/L | D. | 0.7mol/L |
分析 将Cu2O拆分为Cu、CuO,原混合物看做Cu、CuO的混合物,其中一份用足量的氢气还原,反应后固体质量减少3.20g为拆分后Cu、CuO的混合物中O元素的质量,O原子的物质的量为$\frac{3.2g}{16g/mol}$=0.2mol,根据Cu元素守恒可知n(CuO)=n(O)=0.2mol;另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NO气体4.48L,NO的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO),由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu),根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2],据此计算n(HNO3),再根据c=$\frac{n}{V}$计算硝酸的浓度.
解答 解:将Cu2O拆分为Cu、CuO,原混合物看做Cu、CuO的混合物,其中一份用足量的氢气还原,反应后固体质量减少3.20g为拆分后Cu、CuO的混合物中O元素的质量,O原子的物质的量为$\frac{3.2g}{16g/mol}$=0.2mol,根据Cu元素守恒可知n(CuO)=n(O)=0.2mol;另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NO气体4.48L,NO的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO)=3×0.2mol,n(Cu)=0.3mol,由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu)=0.2mol+0.3mol=0.5mol,根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.2mol+2×0.5mol=1.2mol,硝酸的浓度为$\frac{1.2mol}{0.5L}$=2.4mol/L.
故选A.
点评 本题考查混合物的计算、守恒计算等,难度中等,清楚反应过程是解题的关键,本题采取拆分法解答,简化计算过程,注意体会,可以通过列方程解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③④ | C. | ①②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
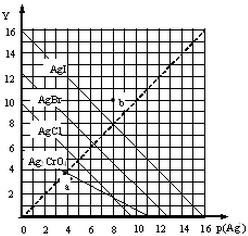 卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )
卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )| A. | 该温度下Ag2CrO4的Ksp约为1×10-22 | |
| B. | a点可表示AgCl的饱和溶液 | |
| C. | b点c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的合成方法有:
的合成方法有: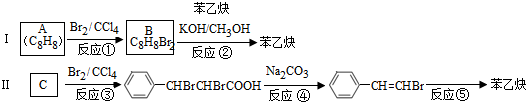
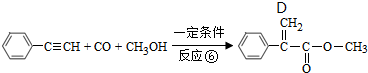
 ,反应①,②涉及的反应类型是加成反应、消去反应.
,反应①,②涉及的反应类型是加成反应、消去反应.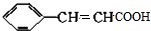 ,反应⑤的化学方程式为
,反应⑤的化学方程式为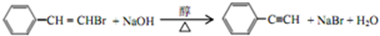 (注明反应条件)
(注明反应条件)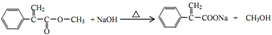 .
.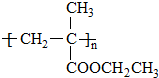 单体的结构简式为CH2=C(CH3)COOCH2CH3.用类似反应⑥的方法,利用合适的原料可以合成该单体,化学方程式为
单体的结构简式为CH2=C(CH3)COOCH2CH3.用类似反应⑥的方法,利用合适的原料可以合成该单体,化学方程式为 .
.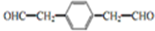 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .其基态原子有26种能量不同的电子;
.其基态原子有26种能量不同的电子;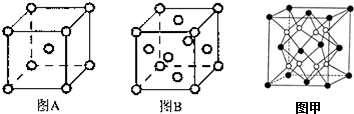
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒投入Cu(NO3)2溶液中,反应后固体物质增重 | |
| B. | 22.4L Cl2通入足量NaOH溶液,反应时转移的电子数为2NA | |
| C. | lmol Na在空气中加热燃烧,反应时转移的电子数为NA | |
| D. | 等物质的量的MgCl2、Ba(OH)2和 HCl溶液混合:Mg2++2OH-=Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
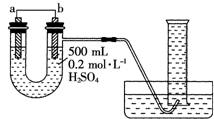 现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | 硝酸 | C. | 醋酸 | D. | 高氯酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com