
���� ��1��2NO2��g��+NaCl��s��?NaNO3��s��+ClNO��g�� K1��H��0 ��I��
2NO��g��+Cl2��g��?2ClNO��g�� K2��H��0 ��II��
���ݸ�˹���ɣ����2-��ɵã�4NO2��g��+2NaCl��s��?2NaNO3��s��+2NO��g��+Cl2��g������÷�Ӧƽ�ⳣ��Ϊ���ƽ�ⳣ��ƽ������ƽ�ⳣ�����̣�
��2�����10min��v��ClNO��=7.5��10-3mol•L-1•min-1�����n��ClNO��=7.5��10-3mol•L-1•min-1��10min��2L=0.15mol���ɷ���ʽ����μӷ�ӦNO�����������ʵ�������������ƽ��ʱ���������ʵ�����NO��ת���ʣ�
�����������ֲ��䣬��Ӧ��II���ں�ѹ�����½��У������ƶ�ʱ���ʵ�����С���൱��ѹǿ����
ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䣬����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ������
��3��0.2mol NaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����2NO2+2NaOH�TNaNO3+NaNO2+H2O���õ���ҺA��NaNO3���ʵ���Ũ��Ϊ0��mol/L��NaNO2���ʵ���Ϊ0.1mol/L��
HNO2�ĵ��볣��Ka=7.1��10-4mol•L-1��CH3COOH�ĵ��볣��Ka=1.7��10-5mol•L-1��˵��CH3COOH����С��HNO2�����ԣ���Һ�д��������ˮ��̶�С�������������ˮ��̶ȣ���ҺB���Դ���A��Һ��
��4����25���£�ƽ��ʱ��Һ��c��NH4+��=c��Cl-��=0.005mol/L�����������غ��c��NH3��H2O��=��0.5a-0.005��mol/L�����ݵ���غ��c��H+��=c��OH-��=10-7mol/L����Һ�����ԣ�NH3•H2O�ĵ��볣��Kb=$\frac{c��O{H}^{-}��c��N{{H}_{4}}^{+}��}{c��N{H}_{3}��{H}_{2}O��}$��
��5����Ka��֪���ԣ�����ǿ����ȡ����ķ�Ӧ��
��� �⣺��1��2NO2��g��+NaCl��s��?NaNO3��s��+ClNO��g�� K1��H��0 ��I��
2NO��g��+Cl2��g��?2ClNO��g�� K2��H��0 ��II��
���ݸ�˹���ɣ����2-��ɵã�4NO2��g��+2NaCl��s��?2NaNO3��s��+2NO��g��+Cl2��g������÷�Ӧƽ�ⳣ��K=$\frac{{{K}^{2}}_{1}}{{K}_{2}}$��
�ʴ�Ϊ��$\frac{{{K}^{2}}_{1}}{{K}_{2}}$��
��2�����10min��v��ClNO��=7.5��10-3mol•L-1•min-1�����n��ClNO��=7.5��10-3mol•L-1•min-1��10min��2L=0.15mol��
�ɷ���ʽ��֪���μӷ�Ӧ���������ʵ���Ϊ0.15mol��$\frac{1}{2}$=0.075mol����ƽ��ʱ���������ʵ���Ϊ0.1mol-0.075mol=0.025mol��
�μӷ�ӦNO���ʵ���Ϊ0.15mol����NO��ת����Ϊ$\frac{0.15mol}{0.2mol}$��100%=75%��
�����������ֲ��䣬��Ӧ��II���ں�ѹ�����½��У������ƶ�ʱ���ʵ�����С���൱��ѹǿ����������еij̶�������ƽ��ʱNO��ת���ʧ�2����1��ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䣬����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ������
�ʴ�Ϊ��0.025��75%���������䣻�����¶ȣ�
��3��0.2mol NaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����2NO2+2NaOH�TNaNO3+NaNO2+H2O���õ���ҺA��NaNO3���ʵ���Ũ��Ϊ0��mol/L��NaNO2���ʵ���Ϊ0.1mol/L����ҺBΪ0.1mol•L-1��CH3COONa��Һ��
HNO2�ĵ��볣��Ka=7.1��10-4mol•L-1��CH3COOH�ĵ��볣��Ka=1.7��10-5mol•L-1��˵��CH3COOH����С��HNO2�����ԣ���Һ�д��������ˮ��̶�С�������������ˮ��̶ȣ���ҺB���Դ���A��Һ������Һ��c��NO3-����c��NO2-����c��CH3COO-���ɴ�С��˳��Ϊc��NO3-����c��NO2-����c��CH3COO-����
A����ҺB���Դ���A��Һ������ҺA�м�����ˮ��ϡ����Һ�����Լ��������ܵ�����ҺpH��ȣ���A����
B������ҺA�м�����NaOH��������ԣ����Ե�����ҺpH��ȣ���B��ȷ��
C������ҺB�м�����ˮ��ϡ����Һ���Լ��������Ե�����ҺpH��ȣ���C��ȷ��
D����ҺB���Դ���A��Һ������ҺB�м�����NaOH����ҺpH����D����
�ʴ�Ϊ��c��NO3-����c��NO2-����c��CH3COO-����BC��
��4����25���£�ƽ��ʱ��Һ��c��NH4+��=c��Cl-��=0.005mol/L�����������غ��c��NH3��H2O��=��0.5a-0.005��mol/L�����ݵ���غ��c��H+��=c��OH-��=10-7mol/L����Һ�����ԣ�NH3•H2O�ĵ��볣��Kb=$\frac{c��O{H}^{-}��c��N{{H}_{4}}^{+}��}{c��N{H}_{3}��{H}_{2}O��}$=$\frac{1{0}^{-7}��5��1{0}^{-3}}{0.5a-5��1{0}^{-3}}$=$\frac{1{0}^{-9}}{a-0.01}$��
�ʴ�Ϊ���У�$\frac{1{0}^{-9}}{a-0.01}$��
��5����Ka��֪̼������Դ���HClO�����ԣ���84����Һ����Ч�ɷ�ΪNaClO����ͨ��������CO2���÷�Ӧ�Ļ�ѧ����ʽΪNaClO+CO2+H2O=NaHCO3+HClO��
�ʴ�Ϊ��NaClO+CO2+H2O=NaHCO3+HClO��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬���ջ�ѧƽ���ƶ����ʱ���㡢����ƽ�ⳣ������Ϊ���Ĺؼ������ط�������������Ŀ��飬�ۺ��Խ�ǿ����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
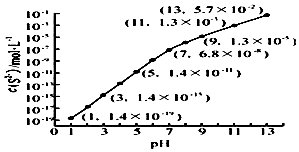 �о���Ԫ�ؼ��仯��������ʾ�����Ҫ���壮
�о���Ԫ�ؼ��仯��������ʾ�����Ҫ���壮 ��
��| Ka1 | Ka2 | |
| H2SO3 | 1.3��10-2 | 6.3��10-4 |
| H2CO3 | 4.2��10-7 | 5.6��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| X | Y | |
| Z | W |
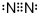 ��Y����Ԫ���γɵ�10�������г���+1��������ΪH3O+���ѧʽ����ͬ����Z����Ԫ���γɵ�18�������г�����-1�������ӵ�ˮ�ⷽ��ʽHS-+H2O?H2S+OH-��
��Y����Ԫ���γɵ�10�������г���+1��������ΪH3O+���ѧʽ����ͬ����Z����Ԫ���γɵ�18�������г�����-1�������ӵ�ˮ�ⷽ��ʽHS-+H2O?H2S+OH-���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����� | ��Ҫ���� | ���� |
| A | ���ھƾ������պ��ͭ˿Ѹ�ٲ�����ˮ�Ҵ��� | ͭ˿��� | CH3CH2OH����������Ӧ����CH3COOH��ͭ˿������� |
| B | �ֱ��ڱ����Ҵ��еμ����Ը��������Һ | �Ϻ�ɫ����ȥ | �����Ҵ����л�ԭ�� |
| C | �ֱ���ˮ���Ҵ��� �������� | ���������� | ����������Ϊ���� |
| D | ���ƾ��ڿ����е�ȼ | ������ɫ���� | �ƾ�����������Ӧ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ƽ��ʱC��ת���ʣ��ң��� | B�� | ƽ��ʱC�����ʵ����ף��� | ||
| C�� | ƽ����Ӧ�ٶȣ��ң��� | D�� | ƽ��ʱA�����ʵ����ף��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| T/�� | 200 | 300 | 400 |
| K | K1 | K3 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
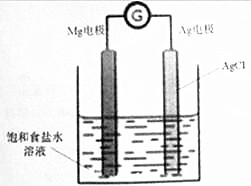 Mg/AgCl�����һ�ֻ�ѧ��Դ����þ�ͱ�����Ȼ�������Ϊ�缫������ʳ��ˮΪ���Һ����ͼ��ʾ�������ķ�Ӧ����ʽΪMg+2AgCl=MgCl2+2Ag������˵����ȷ���ǣ�������
Mg/AgCl�����һ�ֻ�ѧ��Դ����þ�ͱ�����Ȼ�������Ϊ�缫������ʳ��ˮΪ���Һ����ͼ��ʾ�������ķ�Ӧ����ʽΪMg+2AgCl=MgCl2+2Ag������˵����ȷ���ǣ�������| A�� | þ�缫�Ϸ�����ԭ��Ӧ | |
| B�� | ���缫�ĵ缫��Ӧʽ��AgCl+e-=Ag+Cl- | |
| C�� | ��װ��������ת����ʽΪ����ת��Ϊ��ѧ�� | |
| D�� | ��ع���ʱ������������þ�缫���������������缫 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢ� | C�� | �ڢ� | D�� | �٢� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com