
【题目】研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为 而存在于土壤中.处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H K ①
已知:N2(g)+3H2(g)=2NH3(g)△H1=﹣92.4kJmol﹣1 K1 ②
2H2(g)+O2(g)=2H2O(l)△H2=﹣571.6kJmol﹣1 K2 ③
则△H= ;K= (用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3小时,实验数据见下表:
序号 | 第一组 | 第二组 | 第三组 | 第四组 | ||||||||||
t/℃ | 30 | 40 | 50 | 80 | ||||||||||
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 | ||||||||||
下列能说明反应①达到平衡状态的是 (填字母)。K]
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为 ;与前三组相比,第四组反应中NH3生成量最小的原因可能是 。
【答案】(1)硝酸盐;+1530kJmol﹣1;![]() ;
;
(2)bd;3×10﹣4%;催化剂在80℃活性减小,反应速率反而减慢;
【解析】
试题分析:(1)雷雨天气中发生自然固氮反应是O2 +N2![]() 2NO,生成的NO与空气中的氧气反应生成NO2,NO2溶于水转变为HNO3,所以氮元素转化为最后硝酸盐而存在于土壤中;根据盖斯定律①=②×2-③×3,△H=-92.4kJmol-1×2+3×571.6kJmol-1=+1530kJmol-1,K=
2NO,生成的NO与空气中的氧气反应生成NO2,NO2溶于水转变为HNO3,所以氮元素转化为最后硝酸盐而存在于土壤中;根据盖斯定律①=②×2-③×3,△H=-92.4kJmol-1×2+3×571.6kJmol-1=+1530kJmol-1,K=![]() ;
;
(2)反应达到平衡状态的两个根本标志是:各物质的浓度不再变化、同种物质的消耗速率和生成速率相等。在反应2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g)中,a.NH3和O2的物质的量之比为4∶3,不能说明NH3和O2的浓度不再改变,a错误;b.反应混合物中各组份的质量分数不变,说明各物质的质量不变,浓度也就不变,b正确;c.不管在任何时候单位时间内每消耗1molN2的同时生成2molNH3,不能判断是否达到了平衡,c错误;d. 由于H2O液态。反应没有达到平衡,气体的质量会发生改变,如果容器内气体密度不变,说明气体的消耗和生成速率相等,说明反应达到了平衡,d正确;答案选bd;若第三组反应3h后已达平衡,反应的N2的为
4NH3(g)+3O2(g)中,a.NH3和O2的物质的量之比为4∶3,不能说明NH3和O2的浓度不再改变,a错误;b.反应混合物中各组份的质量分数不变,说明各物质的质量不变,浓度也就不变,b正确;c.不管在任何时候单位时间内每消耗1molN2的同时生成2molNH3,不能判断是否达到了平衡,c错误;d. 由于H2O液态。反应没有达到平衡,气体的质量会发生改变,如果容器内气体密度不变,说明气体的消耗和生成速率相等,说明反应达到了平衡,d正确;答案选bd;若第三组反应3h后已达平衡,反应的N2的为![]() ×6.0×10-6mol=3.0×10-6mol,第三组N2的转化率为
×6.0×10-6mol=3.0×10-6mol,第三组N2的转化率为![]() ×100%=3×10-4%;第四组温度最高但达平衡时,氨气的物质的量最小,可能是催化剂在80℃活性减小,反应速率反而减慢。
×100%=3×10-4%;第四组温度最高但达平衡时,氨气的物质的量最小,可能是催化剂在80℃活性减小,反应速率反而减慢。


科目:高中化学 来源: 题型:
【题目】下列有关非金属及其化合物的说法正确的是( )
A. 硅酸可使紫色石蕊试液变红色
B. 二氧化硫通入紫色石蕊试液中.试液先变红后褪色
C. 可用锌粒与稀硝酸反应制备氢气
D. 液溴易挥发,所以存放液溴的试剂瓶中应加水封保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生化学反应H2(g)+I2(g)2HI(g),05min内H2的浓度减少了0.1mol/L,则在这段时间内,用HI表示的平均反应速率为( )
A.0.01molL-1min-1 B.0.2molL-1min-1
C.0.04molL-1min-1 D.0.5molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于阿伏伽德罗常数NA,下列说法正确的是( )
A. 常温常压下,1mol白磷中含有共价键为4NA
B. 标准状况下,22.4L甲醇完全燃烧产生NA个CO2分子
C. 常温常压下,46g NO2、N2O4混合物中,分子数为NA
D. 1L1mol/L Na2CO3溶液中,阴离子个数大于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R有如下反应:RO3-+5R-+6H+=3R2+3H2O,下列说法正确的是
A.元素R位于周期表中第ⅦA族
B.RO3-中的R只能被还原
C.R2在常温常压下一定是气体
D.每反应消耗1 mol RO3-,转移电子的物质的量为5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5 有机化学基础】
某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
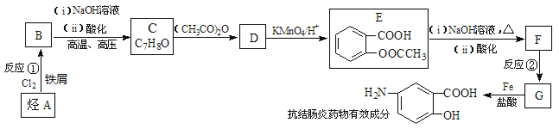
已知: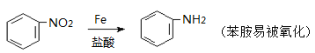
请回答下列问题:
(1)抗结肠炎药物有效成分的分子式是: ;烃A的名称为: ;反应②的反应类型是: 。
(2)①下列对该抗结肠炎药物有效成分可能具有的性质推测正确的是: ;
A.水溶性比苯酚好
B.能发生消去反应也能发生聚合反应
C.1mol该物质最多可与4mol H2发生反应
D.既有酸性又有碱性
② E与足量NaOH溶液反应的化学方程式是: 。
(3)符合下列条件的抗结肠炎药物有效成分的同分异构体有______种。
A.遇FeCl3溶液有显色反应
B.分子中甲基与苯环直接相连
C.苯环上共有三个取代基
(4)已知:苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位,据此按先后顺序写出以A为原料合成邻氨基苯甲酸(![]() )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)
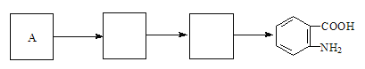
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g),
2C1NO(g),
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
① 2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
② 4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③ 2NO(g)+C12(g)![]() 2C1NO(g) K3
2C1NO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g)![]() 2C1NO(g)反应的△H和a的关系为△H=________kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=________kJ/mol。
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:

① 由图A可判断T1 ________T2,该反应的△H________0 (填“>”“<”或“=”)。
② 反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min)。
③ T2时该反应的平衡常数K=____________。
(4) 一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料。
(1)可燃冰(mCH4·nH2O)属于 晶体。
(2)已知25 ℃、101 kPa 时,1 g甲烷完全燃烧生成液态水放出55.64 kJ热量,则该条件下反应CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)的ΔH=
(3)用甲烷空气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。装置如图所示:
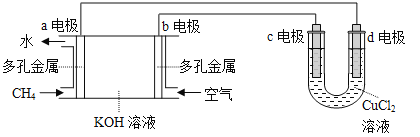
①a电极名称为 。
②c电极的电极反应式为 。
③假设CuCl2溶液足量,当某电极上析出3.2 g 金属Cu时,理论上燃料电池消耗的空气在标准状况下的体积是 L(空气中O2体积分数约为20%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某烃A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)写出A的结构简式 。
(2)A中的碳原子是否都处于同一平面? (填“是”或者“不是”)。
Ⅱ.2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:
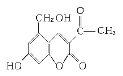
它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(3)下列有关“亮菌甲素”的叙述正确的是 (填字母)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素” 的分子式是C12H10O5
D.“亮菌甲素”分子中含氧官能团只有2种
(4)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其所有属于醇类的同分异构体的结构简式 。
(5)依据核磁共振氢谱分析,二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中含碳、氧元素的质量分数相同,且氢元素的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇的结构简式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com