
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+,对于该平衡下列叙述正确的是( )
A.加入水时,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol·L-1盐酸,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡正向移动
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),生成物并不改变的是
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.NaAlO2和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
|
温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1 000 | e | f | 83.0 |
① b<f ② 915℃、2.0 MPa时E的转化率为60%③ 增大压强平衡左移 ④ K(1 000℃)>K(810℃)
上述①~④中正确的有( )
A.4个 B.3个
C.2个 D.1个
查看答案和解析>>
科目:高中化学 来源: 题型:
0.1mol·L-1HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
A.c(H+)>c(F-) B.c(H+)>c(HF)
C.c(OH-) >c(HF) D.c(HF)>c(F-)
查看答案和解析>>
科目:高中化学 来源: 题型:
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是( )
A.2CN-+H2O+CO2===2HCN+CO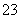
B.2HCOOH+CO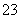 ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN,消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于常温下电解质溶液的叙述中,正确的是( )
A.碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应:HCO +OH-===CO
+OH-===CO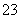 +H2O
+H2O
B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH )=c(Cl-)+c(OH-)
)=c(Cl-)+c(OH-)
C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液,溶液中c(NH )前者大于后者
)前者大于后者
D.25℃时,pH=8的0.1 mol·L-1NaX溶液中由水电离出的c(OH-)=1×10-8 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是对化学反应变化过程及结果的研究。按要求回答问题:
Ⅰ.关于反应速率和限度的研究
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则等物质的量浓度的①CH3COONa、②NaCN、③Na2CO3、④NaHCO3溶液的pH由大到小的顺序为__________(填编号)。
(2)已知2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1,在一个容积为2 L的容器中加入2 mol SO2和1 mol O2,在某温度下充分反应,经过30 min达到平衡,放出热量176.94 kJ。如果用SO2表示该反应的反应速率,则v(SO2)=________。
(3)下图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是________。
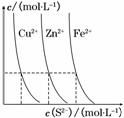
向新生成的ZnS浊液中滴入足量含相同浓度的Cu2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为________(填化学式)沉淀。
Ⅱ.关于电化学的研究
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:VO +2H++V2+
+2H++V2+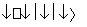 V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。
V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,萘可以被浓硝酸、浓硫酸的混酸硝化生成二硝基物,它是1,5二硝基萘( )、1,8-二硝基萘(
)、1,8-二硝基萘(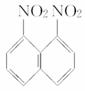 )的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可以将这两种同分异构体分离,将上述硝化产物加入适量的98%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8二硝基萘,应采用的方法是
)的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可以将这两种同分异构体分离,将上述硝化产物加入适量的98%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8二硝基萘,应采用的方法是
( )
A.蒸发浓缩结晶
B.向滤液中加水后过滤
C.用Na2CO3溶液处理滤液
D.将滤液缓缓加入水中并过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示,据图分析,下列判断错误的是( )
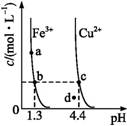
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com