
【题目】用下列装置(夹持仪器已略去)进行相关实验,装置正确且能达到实验目的的是( )
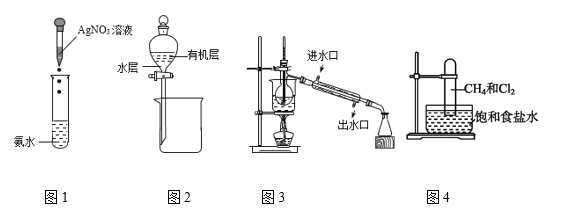
A. 图1装置配制银氨溶液
B. 图2装置分离苯萃取碘水后已分层的水层与有机层
C. 图3装置进行石油的分馏
D. 图4装置CH4和Cl2完全反应后液面上升,液体充满试管
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
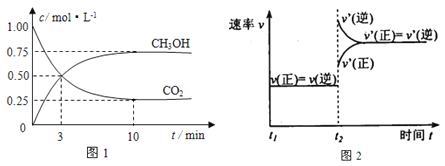
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=_________________。500℃达平衡时,CH3OH(g)的体积分数为_______,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为____反应(填“放热”或“吸热”)。
(2)500℃该反应的平衡常数为_______(保留两位小数),若提高温度到800℃进行,达平衡时,K值_____(填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是________________。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂 E.将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0. 5mol/L,则此时v(正)_____v(逆)(填“>”“<”或“=”)。
(5)下列措施能使n(CH3OH)/n(CO2)增大的是______。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用资源,加强环境保护,降低碳排放,实施低碳经济是今后经济生活主流。回答下列问题:
(1)下列措施不利于有效减少二氧化碳的是_______(填字母)。
a.植树造林,保护森林,保护植被
b.加大对煤和石油的开采,并鼓励使用液化石油气
c.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发
d.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
(2)科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1:4的物质的量之比混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式:
CO2+4H2![]() _______+2H2O
_______+2H2O
(3)用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2 mol CO2和6 mol H2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),能判断该反应已达化学平衡的标志是____(填字母)。
CH3OH(g)+H2O(g),能判断该反应已达化学平衡的标志是____(填字母)。
a.CO2百分含量保持不变
b.容器中混合气体的质量保持不变
c.容器中H2浓度与CO2浓度之比为3:1
d.CO2的生成速率与CH3OH的生成速率相等
现测得CO2相CH3OH (g)的浓度随时间变化如图所示。
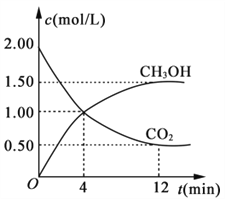
从反应开始到平衡,氢气的平均反应速率v(H2)=________。
(4)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2 CO3+6H2O。通入甲醇的电极为燃料电池的______(填“正”或“负”)极,正极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为______(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为__________;
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是____(填标号)。
A.c(H+)>c(OH-) B.c(H+)<c(OH-)
C.c(H+)+c(HCN) = c(OH-) D.c(HCN)+ c(CN-)=0.01mol/L
(4)已知NaHCO3溶液呈碱性,原因是____(用离子方程式表示);请写出该溶液中各离子浓度的大小_____________,电荷守恒表达式_________;
II:按要求填空:
(1)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的____________。
(2)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理_______;
(3)将25℃下pH=12的NaOH溶液aL与pH=1的HCl溶液b L混合,若所得混合液为中性,则a:b=_____。(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。
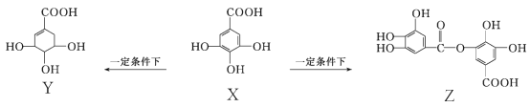
下列说法错误的是
A. 1 mol Z最多能与8 mol NaOH发生反应
B. 1 mol X与H2完全加成产物的分子式为C7H12O5
C. 向Y中滴加FeCl3溶液呈紫色
D. 1 mol Y与足量的金属钠反应放出2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的合成路线如下图所示:
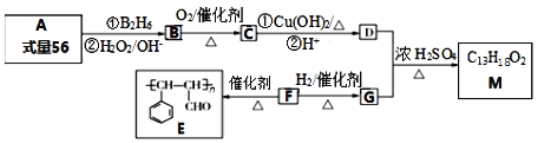
已知:(1)A是含一个支链的烃;
(2)R-CH=CH2 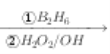 R-CH2CH2OH。
R-CH2CH2OH。
请回答下列问题:
(1)有机物A的系统命名为_______________。
(2)F中官能团的名称为:______________;F与新制的氢氧化铜悬浊液反应的化学方程式:________。
(3)D+G→ M的反应方程式为_____________。
(4)X是G的同系物,且相对分子质量比G小14,X有多种同分异构体。X中满足与FeCl3溶液反应显紫色,其核磁共振氢谱显示有4种不同化学环境的氢,且峰面积比为1:1:2:6的结构简式为_________。
(5)参照M的合成路线,设计一条由丙烯为起始原料制备丙酸丙酯的合成路线无机试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是![]()
![]()
A. CS2是V形分子 B. SnBr2键角大于![]()
C. BF3是三角锥形分子 D. NH4+键角等于10928ˊ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
A. ①②B. ①③C. ②③D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com