
X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。
| 0.01 mol·L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(1)X、W的化学式分别为________、________。
(2)W在溶液中的电离方程式为________________________________________________________________________。
(3)25 ℃时,Z溶液的pH>7的原因是__________________________(用离子方程式表示)。
(4)将X、Y、Z各1 mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为____________________________________________。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为____________________________________________。
8.(1)NaOH NH4NO3
(2)NH4NO3===NH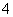 +NO
+NO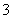
(3)NO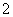 +H2O
+H2O
 HNO2+OH-
HNO2+OH-
(4)c(Na+)>c(NO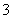 )>c(NO
)>c(NO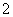 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
(5)NaNO2+NH4NO3===NaNO3+N2↑+2H2O
[解析] HNO3是强酸、NaOH是强碱,NH4NO3是强酸弱碱盐、NaNO2是强碱弱酸盐,因NH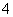 、NO
、NO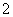 的水解是微弱的,而NaOH、HNO3的电离是完全的,从溶液的pH可知X、Y、Z、W分别为NaOH、HNO3、NaNO2和NH4NO3。
的水解是微弱的,而NaOH、HNO3的电离是完全的,从溶液的pH可知X、Y、Z、W分别为NaOH、HNO3、NaNO2和NH4NO3。
(4)三者的混合溶液为NaNO3和NaNO2的混合溶液,故溶液呈碱性,离子浓度的大小顺序为c(Na+)>c(NO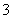 )>c(NO
)>c(NO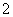 )>c(OH-)>c(H+)。
)>c(OH-)>c(H+)。
(5)NaNO2与NH4NO3溶液混合生成的无色无味的气体应为N2。这是由于NaNO2中+3价的氮元素与NH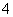 中-3价的氮元素发生反应NaNO2+NH4NO3===NaNO3+N2↑+2H2O。
中-3价的氮元素发生反应NaNO2+NH4NO3===NaNO3+N2↑+2H2O。


科目:高中化学 来源: 题型:
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如图K72所示。
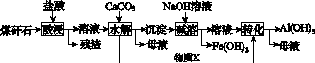
图K72
(1)写出“酸浸”过程中主要反应的离子方程式:
________________________________________________________________________、
________________________________________________________________________。
(2)“酸浸”时铝浸出率的影响因素可能有________________、________________。(写出2个)
(3)物质X的化学式为________。“碱溶”时反应的离子方程式为__________________________。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。
为了获得Al(OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过程是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体。结合化学平衡移动原理解释析出晶体的原因:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O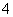 )
)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
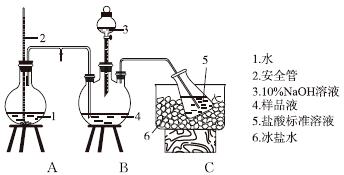
氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是__________________________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是____________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO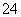 )为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;X的制备过程中温度不能过高的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Na+、K+、MnO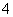 、CO
、CO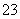
B.c(H+)=1×10-13 mol·L-1的溶液中:Mg2+、Cu2+、SO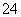 、NO
、NO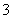
C.0.1 mol·L-1NH4HCO3溶液中:K+、Na+、NO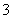 、Cl-
、Cl-
D.0.1 mol·L-1FeCl3溶液中:Fe2+、NH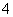 、SCN-、SO
、SCN-、SO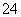
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化工生 产过程中所发生的反应不属于氧化还原反应的是( )
产过程中所发生的反应不属于氧化还原反应的是( )
A.用氯气和消石灰制漂白粉 B.用氢气和氮气合成氨
C.用铝土矿冶炼金属铝 D.用油脂制肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于阴影3区域的是( )
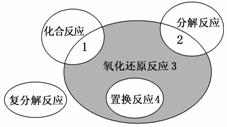
A.Cl2+2NaI===2NaCl+I2
B.NH4HCO3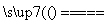 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.Fe2O3+3CO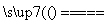 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
欲从苯酚的乙醇溶液中回收苯酚,有下列操作:
①蒸馏;②过滤;③分液;④加入足量的钠;⑤通入过量的CO2;⑥加入足量的NaOH溶液;⑦加入足量的FeCl3溶液;⑧加入乙醇和浓硫酸的混合液;⑨加入足量的浓溴水;⑩加入适量盐酸。
合理的步骤是( )
A.④⑤⑩ B.⑥①⑤③
C.⑨②⑧① D.⑦①③⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的的失败原因是因为缺少必要的实验步骤造成的是( )
① 将乙醇和乙酸混合,再加入稀硫酸共热制乙酸乙酯
② 实验室用无水乙醇和浓硫酸共热到140℃制乙烯
③ 验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银溶液出现褐色沉淀
④ 做醛的还原性实验时,当加入新制的氢氧化铜悬浊液后,未出现红色沉淀
⑤ 检验淀粉是否水解时将淀粉与少量稀硫酸加热一段时间后,加入银氨溶液后未析出银镜
A.①④⑤ B.①③④⑤ C.③④⑤ D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com